お知らせ
COPD治療薬に気管支喘息の適応追加へ - 新薬情報
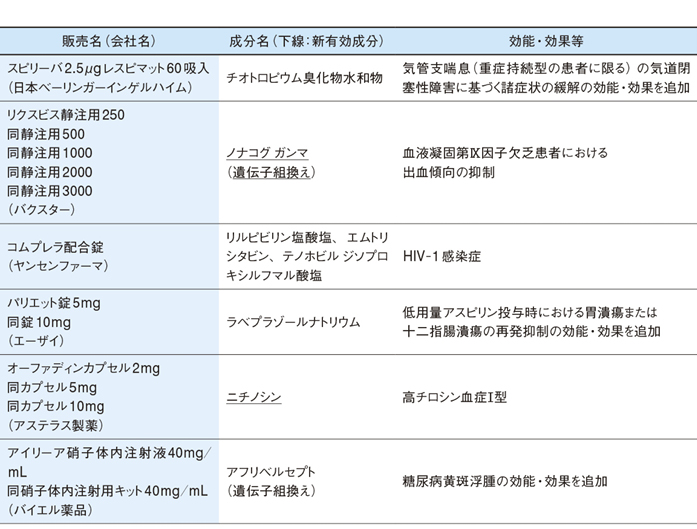
厚生労働省は10月27日と29日に、薬事・食品衛生審議会医薬品第二部会と第一部会を開き、下掲の6成分14品目について、承認して差し支えないとの結論をとりまとめた。
このうち、日本ベーリンガーインゲルハイムの慢性閉塞性肺疾患(COPD)治療薬「スピリーバ」は、気管支喘息に対する適応の追加が了承された。
同剤は、気管支収縮抑制作用を持つ長時間作用型抗コリン薬(LAMA)の吸入液剤。追加される効能・効果の対象は、気道閉塞性障害に基づく諸症状で日常生活が制限されるような「重症持続型」の患者。通常、成人には1日1回2吸入を投与する。
ヤンセンファーマのヒト免疫不全ウイルス1型(HIV-1)感染症治療薬「コムプレラ」は、「リルピビリン塩酸塩」「エムトリシタビン」「テノホビル ジソプロキシルフマル酸塩」の3成分の配合剤。承認されれば、『抗HIV治療ガイドライン2014年3月版』で提唱されている、3剤併用による抗レトロウイルス療法を1日1回1錠の服用で行うことができるため、販売元のヤンセンファーマは「患者の長期服薬における負担の軽減が期待できる」としている。
「ランタス」のバイオ後続品が年内承認へ
第一部会ではこのほか、日本イーライリリーのインスリングラルギン製剤「リリー」について、医薬品医療機器総合機構(PMDA)が承認を了承したとの報告があった。
同剤は、サノフィが販売する「ランタス」のバイオ後続品(バイオシミラー)で、効能・効果は先行品のランタス同様、「インスリン療法が適応となる糖尿病」。早ければ12月にも承認される見通しだ。
バイオ後続品は、先行バイオ医薬品の特許が切れた後に、同等・同質の品質、安全性、有効性を有する医薬品として、別会社によって開発・製造されるもの。