お知らせ
Ⅴ-8)アポトーシスとネクローシス
- 登録日:
- 2017-06-26
- 最終更新日:
- 2017-06-26
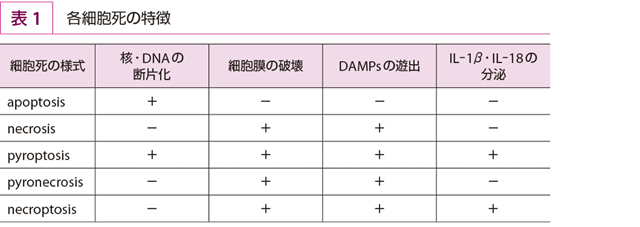
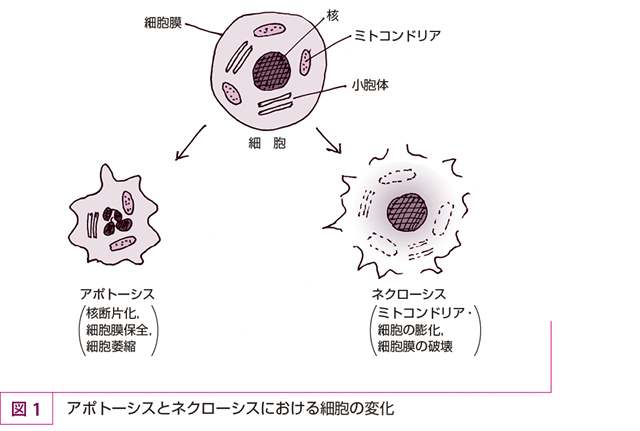
核クロマチンの濃縮,DNAの断片化,核の断片化,細胞の萎縮を生じ,細胞膜は保全されているような細胞死をアポトーシス(apoptosis)という(表1,図1)。細胞膜に包まれた形で細胞が分断化したものをアポトーシス小体という。
細胞膜が傷害されると細胞内のATP,尿酸,ストレス蛋白(HSP),HMGB1などのDAMPs(damage-associated molecular patterns)が遊出し,マクロファージなどがそれに反応して炎症性サイトカインを産生し,炎症反応が生じるのであるが,アポトーシスではそのようなことがない。したがって,生理的機構としての細胞死(老化,活性化誘導細胞死など)はアポトーシスによる。
アポトーシスを起こした細胞はマクロファージによってとらえられ,消化を受けて処理されるが,そのような処理を受けないといずれ細胞膜の破壊も生じる。これを2次ネクローシス(secondary necrosis)という。細胞がFasを表出して起こす細胞死や,放射線などおだやかな物理的・化学的ストレスを受けたときの細胞死で生じる。
一方,ミトコンドリアの膨化,細胞の膨化,細胞膜の破壊,DAMPsの遊出を伴うような細胞死をネクローシス(necrosis)という(表1,図1)。DAMPsの遊出が起こると,周辺組織に傷害が及ぶ可能性がある。補体による細胞融解,細菌毒素,高温,低酸素などによる細胞死で起きる。
核,DNAの断片化と同時に細胞膜の傷害,DAMPsの遊出,IL-1β,IL-18の分泌を伴う細胞死を,ピロトーシス(pyroptosis)という(表1)。細胞質のパターン認識レセプターNLR(NOD-like receptor)で微生物などに反応するとカスパーゼ1が活性化され,IL-1β,IL-18の前駆体はそれで切断されてIL-1β,IL-18となって分泌される。IL-1β,IL-18は炎症反応を導く。カスパーゼ1はgasdermin-Dを分解,その産物は細胞膜に孔をあける。ピロトーシスを誘導する際に形成されるNLR・ASC蛋白・プロカスパーゼ-1複合体を,pyrosomeという。この複合体形成によってカスパーゼ1の活性化が生じ,IL-1β,IL-18の分泌とともに細胞死が誘導されるのである。
Fas分子,TNFレセプター,TLRへの刺激で起きるアポトーシスにはカスパーゼ8の活性化が関与しているが,FLIPでカスパーゼ8が抑制されるような状況ではキナーゼRIP-1,RIP-3の複合体が形成されて,RIP-3が働きミトコンドリアから活性酸素を産生させる。この場合,核の断片化は生じないが,細胞膜が傷害を受け,DAMPsが流出する。そしてIL-1β,IL-18の分泌も生じる。このような細胞死をネクロトーシス(necroptosis)という(表1)。活性化によりFasを表出し,それへの作用で起こすようなところから,仕組まれた細胞死ともいえ,計画されたネクローシス(programmed necrosis)ともいわれる。RIP-1・RIP-3複合体はネクロトーシスをもたらすことから,necrosomeと呼ばれる。
TNF-αなどの作用でASC,RIPが働きカテプシンBが活性化されて,細胞が膨化し,細胞膜が傷害される細胞死はピロネクローシス(pyronecrosis)という(表1)。カスパーゼは活性化されず,DNAの断片化は生じない。DAMPsが遊出するが,IL-1β,IL-18の分泌はみられない。






























