お知らせ
小児のボタン電池誤飲を防ぐために─低電圧1.5Vのボタン電池でも組織傷害性アルカリは生成される(第2報)[提言]
前報のダイジェスト
ボタン電池の誤飲事例は後を絶たない。ボタン電池の誤飲に関する東京都等の実験および,実態調査等が行われ,特に,コイン形の3Vの高電圧ボタン電池の誤飲の危険性は多数報告されてきた。以前から,1.5Vの低電圧のボタン電池は,3Vよりは危険性が低いと考えられてきた。しかし,乳児の食道や鼻腔,眼部などに嵌頓すると,アルカリによる組織傷害を引き起こし危険である。この組織傷害性のアルカリは,電池の放電とともに生成されるのだが,いまだに,食塩水の電解反応だとする説明と,陽極の腐食と同時に起こる(カップリング)のだとする説明が,併行したままである。
我々は,化学反応における平衡論(自由エネルギー変化)と,ボタン電池の生理食塩水浸漬実験結果から,1.5Vの低電圧のボタン電池でも組織傷害性のアルカリが生成されるのは,陽極の腐食と同時に起こることが大きいからであると考えた。

しかし,これだけでは,東京都の実験における,1.5Vのボタン電池を接触させた組織(鶏肉)がpH=15の強アルカリとなった結果の説明ができなかった。
そこで,我々は第2報において陰極の半反応を再考し,この実験結果の仮説を試みることとした。
〔要旨〕ボタン電池が粘膜組織に嵌頓すると陰極で組織傷害性のアルカリが生成される。これは水の還元により水素とともに水酸化物イオンが生じる半反応で説明されている。我々は,食塩水による鉄の腐食についてのエヴァンスの(液滴)実験という古典的な教育展示実験の知見から,低電圧1.5 Vでの水酸化物イオン生成には水の還元に加えて溶存酸素の還元も若干寄与していると推定した。
1 実験の経緯
ボタン電池が粘膜組織に嵌頓すると陰極で組織傷害性のアルカリが生成される。ボタン電池には1.5Vのボタン形電池(主にアルカリ電池)と3Vのコイン形電池(リチウム電池)がある。我々は前報1)にて平衡論(自由エネルギー変化)から,1.5Vの低電圧でも水の還元により水酸化物イオンが生成される
(1)陰極:2H2O+2e-→H2+2OH-
という半反応2)が生じるのは,
(2)陽極:Fe→Fe2++2e-,Ni→Ni2++2e-
という鉄やニッケルが溶出する半反応2)3)とカップリングしているためと考えた。溶出した金属の変化は詳細不明であるが,ChevinらはFe(OH)3として析出すると考えている4)。
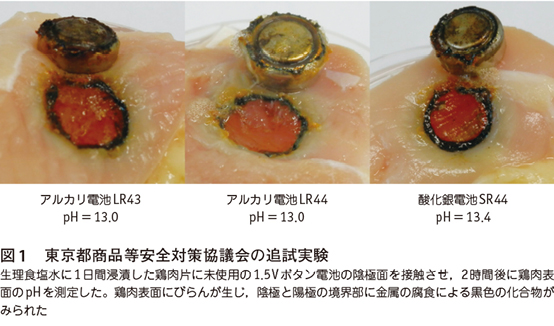
ところで東京都商品等安全対策協議会から,生理食塩水に浸した鶏肉にボタン電池を接触させたところ陰極部分のpHが15になったという実験報告がある5)。pH=15は水酸化Naの飽和溶液に近い強アルカリであり,我々の追試ではpH=13が測定された(図1)。そこで我々はこれまであまり検討されていなかった陰極の半反応について考えてみた。
2 エヴァンスの実験─食塩水による鉄の腐食におけるアルカリ生成
日常的な鉄のさび(腐食)に起きている電気化学的反応を視覚的に示したエヴァンスの液滴実験という教育展示実験がある6)。鉄板に2つの試薬を加えた食塩水を滴下する実験で,わが国では食塩水に鉄釘を浸すかたちにモディファイされエヴァンスの実験と言われている7)~9)。pH指示薬のフェノールフタレインとフェリシアン化K[K3〔Fe(CN)6〕,別名ヘキサシアニド鉄(Ⅲ)酸K]を加えた食塩水をシャーレに浅く注ぎ,鉄釘を浸すとピンク色の部分と青色の部分が現れるという結果である7)。ピンク色は食塩水の溶存酸素が還元される半反応式
(3)陰極:O2+2H2O+4e-→4OH-
によるアルカリの生成で,中性で無色のフェノールフタレインが変化したものである。また青色は半反応式(2)による2価の鉄イオンFe2+の溶出で,Fe2+とK3〔Fe(CN)6〕が反応してターンブル青(紺青)すなわちベルリン青という色素を形成したものである6)。
このエヴァンスの実験は低電圧1.5Vでもアルカリが生成される理由を考える上で興味深い。すなわち鉄釘が,酸素が溶けた食塩水と反応するだけでその表面に陰極と陽極が発生し,電池のようになることである。これを局部電池(本来の電池と異なり外部に電流は取り出せない)という。半反応式(2)と(3)を併せた全反応は,
(4)2Fe+O2+2H2O→2Fe2++4OH-
である。この反応の標準自由エネルギー変化ΔG゜を前報の通り計算すると,電子1mol当たり-78kJで,この値が負であることは反応が自発的に起きることを意味しており,起電力Eに換算してpH=14で0.81V,pH=7で1.02Vである。つまり鉄の腐食とアルカリの生成は食塩水と酸素があれば自然に起こり,それを示したエヴァンスの実験は酸素が多い鉄釘と液面の境界辺りからピンク色になるのが観察される7)~9)。
食道は酸素分圧が低いので半反応式(3)の影響は小さいかもしれないが,ボタン電池の鼻腔内への挿入では1.5Vでも鼻中隔が容易に穿孔する10)。これは電池が空気と触れていることが一因かもしれない。

残り2,402文字あります
会員登録頂くことで利用範囲が広がります。 » 会員登録する