お知らせ
【Breakthrough 医薬品研究開発の舞台裏(7)坂口佐知(日本イーライリリー 研究開発本部オンコロジー領域 臨床開発医師)】新たなCDK4/6阻害薬「ベージニオ」、乳がん患者への連日投与が可能に

臨床現場のニーズを反映した研究開発を進めるために、製薬企業で働く医師の役割がますます重要となっている。オンコロジー領域の臨床開発医師として日本イーライリリーに勤務する坂口佐知さんは、小児がんの診療に携わってきた経験を開発に活かすとともに、開発した新薬の情報を臨床現場に適切に提供する役割を担っている。この1年は、ホルモン受容体陽性・HER2陰性の乳がんを対象としたCDK4/6阻害薬「ベージニオ錠」(2018年9月承認、同年11月発売)の市販後のフォローに奔走してきた。「ベージニオ」の特性・開発経緯、市販後のフォローで学んだことなどについて坂口さんに話を聞いた。


さかぐち さち:2001年筑波大医学専門学群卒。トロント小児病院(カナダ)臨床薬理部門clinical fellow、順天堂大小児科腫瘍グループ助教などを経て、16年より現職。
─乳がん治療薬「ベージニオ」(一般名:アベマシクリブ)は類薬と比べてどのような特徴があるのですか。
坂口 一番わかりやすい特徴は、CDK4/6阻害薬の中で唯一連日投与可能な経口製剤というところです。
CDK4/6阻害薬は世界にほかに2種類ありますが、いずれも「3週間投与して1週間休薬」という用法になっています。CDK4/6阻害薬は、細胞周期の調節に主要な役割を果たすサイクリン依存性キナーゼ(CDK)4/6を選択的に阻害し、細胞周期を停止させる分子標的薬で、効いている間は細胞周期が止まり、効かなくなると細胞が増殖しますので、その作用機序をシンプルに考えると休薬なしで投与を続けられるほうがいいわけです。しかし、骨髄抑制の副作用があるため、どうしても休薬を挟まなくてはならないということがネックになっていました。
イーライリリーでは当初から「休薬なしで投与できる薬をつくる」ことを目標に開発を始め、開発者の表現を借りると「干し草の中から針を探す」ような作業で実験を繰り返し、アベマシクリブを見つけました。

2つの適応症で同時申請
─治験中はどのような苦労がありましたか。
坂口 臨床試験では、内分泌療法治療歴のある手術不能/再発乳がん患者を対象としたMONARCH2試験と、内分泌療法治療歴のない手術不能/再発閉経後乳がん患者を対象としたMONARCH3試験という2つのフェーズ3試験が進められました。
最初にMONARCH2の最終解析結果が出て、これをもって米国で承認を取得したのですが、少し間をあけてMONARCH3の中間解析でも有効という結果が出たため、日本チームは、最終解析結果と中間解析結果を合わせて2つの適応症の承認を同時申請しようと決断しました。当時の担当者はかなり苦労しましたが、「有効という結果が出た限りは患者さんに1日でも早く薬を届けたい」という思いで当局とも協議を重ね、最終的に両方の適応症で承認を取得するに至りました。
─ほかに開発中のエピソードはありますか。
坂口 アベマシクリブの開発は当初カプセル剤で行われていたのですが、「飲みやすさを考えるとやはりタブレットのほうがいい」という意見を日本チームからグローバルに出し、いろいろな方向から手をかえ品をかえ訴えた結果、最終的に世界共通でタブレットに統一されたという経緯があります。
実臨床の情報の大切さを痛感
─「ベージニオ」を実臨床で使用する上で特に注意してほしい点は何ですか。
坂口 「重度の下痢」「間質性肺疾患」「骨髄抑制」「肝機能障害」の4つの副作用に特に注意していただきたいと思っています。
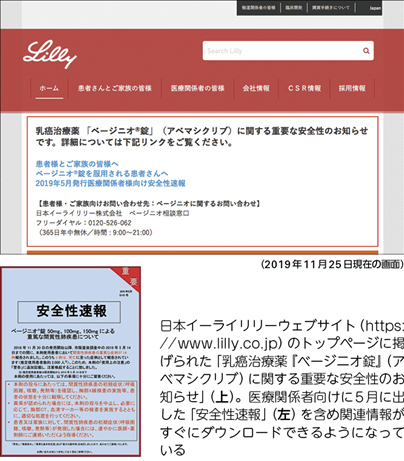
間質性肺疾患に関しては、治験中は日本の患者さんでの死亡例はなかったのですが、昨年11月30日に上市した後、死亡例を含め重篤な症例の報告があり、今年5月に添付文書の「警告」欄に間質性肺疾患に関する注意喚起を追加記載し、その旨を安全性速報(ブルーレター)で全国の医療関係者に伝達することになりました。
この件では、治験で得られた安全性のデータだけでは実診療では必ずしも十分でない場合があり、製薬会社は、実診療でどのように安全性を担保しながら使っていただくかというところまできちんと責任を持たなけれ ばならないということをあらためて学びました。市販後は現場の先生方の協力なくして情報収集はできませんので、注意喚起を徹底するには先生方や患者さんからの声が大きな助けになるということを痛感しました。
─「ベージニオ」の安全性に関しては、ウェブサイトのトップでも情報提供していますね。
坂口 「自分たちで情報発信できることはすべてしよう」ということで、まずはウェブサイトの一番上に情報を置くことにしました。死亡に至った患者さんを含め重篤な症例が出たことは社内中で非常に重く受け止めています。
─骨髄抑制や肝機能障害の副作用に関してはどのように対応していけばいいですか。
坂口 この2つに関しては、きちんとフォローアップし必要に応じて休薬・減量する対策が何よりも大事です。最初の2カ月は2週間に1回、その後も定期的に血液検査を行っていただくよう注意喚起をしています。
ちょうど11月の終わりで2週間の処方制限が解除されますので、定期の採血の漏れが出ないよう周知していきたいと思っています。
医療現場から企業にフィードバックを
─坂口さん自身、臨床現場から製薬業界に入ってあらためて気づかされたことはありますか。
坂口 臨床現場で医師をしているときは、特に小児がんを専門にしていましたので、「患者数が少ない領域には製薬企業は力を入れないだろう」「一介の医者が何か言ったところで会社は動いてくれない」とあきらめているところがありました。しかし実際に入ってみると、製薬企業は思っていた以上に現場からのフィードバックを大事にしています。
ベージニオ開発中も患者さんの講演を聴く機会があり、転移乳がんの患者さんは非常に孤独を感じながら闘っていることを知り、待っている患者さんたちのためになんとか同時申請をやり遂げようと思うことができましたし、自分たちの方向性を見失わないために現場の生の声を聴けるということは非常に大事だと感じました。すぐに変わることができない面もありますが、現場の先生方にはぜひ、近くのMRなどを通じて遠慮せず思うところを伝えていただきたいと思います。
私自身、今後はぜひ、現場から強い要望のある小児がんの新薬開発にも携わっていきたいと思っています。