お知らせ
緊急寄稿(2)新型コロナウイルス感染症(COVID-19)治療候補薬アビガンの特徴(白木公康)


しらき きみやす:1977年阪大卒。2013年富山大学医学部学科長,2019年4月から現職。専門は臨床ウイルス学。新型コロナウイルス感染症の治療薬の候補に挙がっている抗インフルエンザウイルス薬ファビピラビル(商品名:アビガン)を開発

No.5004 緊急寄稿(1)新型コロナウイルス感染症(COVID-19)のウイルス学的特徴と感染様式の考察
No.5006 緊急寄稿(3)COVID-19を含むウイルス感染症と抗ウイルス薬の作用の特徴
No.5036 緊急寄稿(4)新型コロナウイルス感染症(COVID-19)に対するアビガン承認に向けて
1. はじめに
新型コロナウイルス感染症(COVID-19)が世界各地に広がっている。中国では,ファビピラビル(6-fluoro-3-hydroxy-2-pyrazinecarboxamide,商品名:アビガン)が有効な治療薬剤として評価されている。アビガンは致死性インフルエンザ感染動物モデルで,オセルタミビルリン酸塩(商品名:タミフル)が有効でない場合にも全動物を生存させるという,高ウイルス負荷の致死性感染症を有効に治療できる薬剤である。2014年に西アフリカで流行したエボラ出血熱の治療にも有効に使われた。その後,重症インフルエンザ肺炎に対するアビガンとタミフルの併用療法の有効性が報告されている。このほか,人の致死性RNAウイルス感染症の治療や,わが国では,重症熱性血小板減少症候群の治療にも使用された。そこで本稿では,アビガンの特徴やアビガン以外のCOVID-19治療候補薬について概説する。
2. アビガンの開発経緯
高い合成能力を有する富山化学工業(当時)と,ウイルス感染動物モデル実験系を有していた私たち富山医科薬科大学(当時)は,当初,抗ヘルペス薬の共同開発を目指していたが,アシクロビルを超える化合物を得られなかった。富山化学で合成された化合物は,抗ウイルス,抗菌,抗炎症,神経などの分野でその活性がスクリーニングされており,約3万化合物の中の1つがインフルエンザに活性を有していた。そこから,開発番号T-705(アビガン)の開発がスタートした。
アビガンは江川裕之氏らが合成し,古田要介氏らが細胞培養で抗インフルエンザ活性を見出し,富山医科薬科大学の感染動物実験施設(BSL3)において,インフルエンザ感染動物で治療効果を確認したことで,抗インフルエンザ薬としての道を歩み始めた1)。
3. アビガンの抗インフルエンザウイルス活性
アビガンの化学構造は図1に示したように,アビガンにリボースが付加されると,生体内に存在するAICARに構造が似る。AICARはRNAの材料となるグアノシンやアデノシンの前段階のイノシンに至る前駆物質である。そのため,ウイルスのRNA依存性RNA合成酵素(RdRp)は,伸長中のウイルスRNAに,アビガンをグアノシンやアデノシンと間違えて取り込んでしまい,そこで,RNA合成が停止する。すなわち,アビガンは,RNAウイルスのRNA複製の際に,RNA鎖に取り込まれたところで,RNAの伸長を停止する。この機構は,アシクロビルと同じように,伸長阻止薬(chain terminator)として作用する。そして,アビガンの阻害活性はインフルエンザウイルスだけでなく,ほとんどのRNAウイルスのRdRpに対して,伸長を停止する活性を有する。
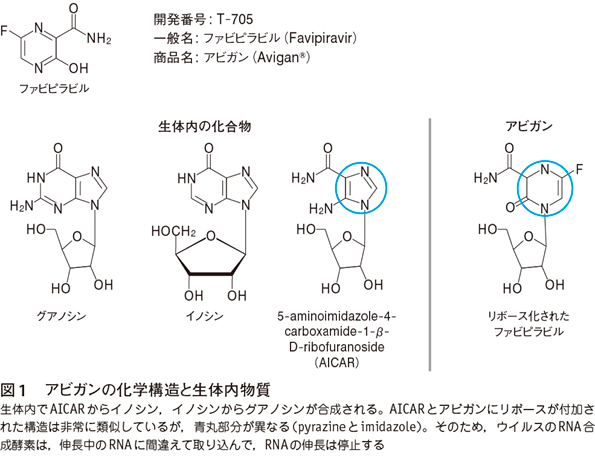
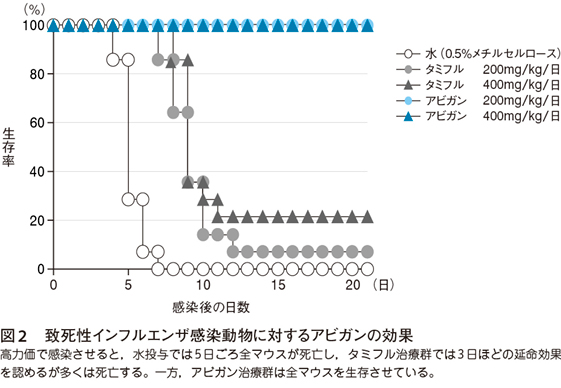
このような活性を有するアビガンがインフルエンザ感染動物で治療効果を示すことを確認した後,この抗インフルエンザ活性は他の抗インフルエンザ薬に比べて優れているのか,優れているのはどのような点か,という差別化の試験を行った。インフルエンザ感染動物を用いた試験では,軽症の感染ではタミフルとアビガンの治療効果に差異は認めなかった。一方,図2に示したように,致死性の高力価インフルエンザ感染モデルでは,タミフル治療で3日ほどの延命は得られるが多くのマウスが死亡する。しかしアビガンは,すべてのマウスを生存させるという強い治療効果を示した2)。このRNAウイルスの致死性感染症に対する生存効果は,その後,エボラ出血熱等への治療の際に効果を発揮した。
4. ヒトにおけるインフルエンザ治療効果
米国国防総省は,新型インフルエンザや致死性RNAウイルス感染症に対するアビガンの効果を期待して,季節性インフルエンザに対するアビガンの治験を行った。わが国でも季節性インフルエンザに対するアビガンの治験を行い,抗インフルエンザ薬としての臨床効果が認められ,2014年3月,承認を得ることとなった。これらヒトでの国内臨床試験および国際共同第Ⅲ相試験(承認用法および用量より低用量で実施された試験)において,安全性評価対象症例501例中,副作用が100例(19.96%)に認められた(臨床検査値異常を含む)。主な副作用は,血中尿酸増加24例(4.79%),下痢24例(4.79%),好中球数減少9例(1.80%),AST(GOT)増加9例(1.80%),ALT(GPT)増加8例(1.60%)等であった(添付文書に記載)。この結果からは,試験対象者に対して強い毒性があるようには思われない。アビガンは,主に水酸化体として尿中に排泄される腎排泄性薬剤であり,1日1回の投与では血中濃度を保つことは難しい。治験の際,アビガン投与前後で,57ペアのインフルエンザウイルスの感受性に変化はなく,タミフルやバロキサビル マルボキシル(商品名:ゾフルーザ)のように耐性ウイルスは分離されなかった3)。アビガンに耐性が生じないことはインフルエンザウイルスのほか,ポリオウイルスで確認した4)。
致死性インフルエンザ感染でも全マウスが生存するという優れた治療効果,そして,耐性ウイルスができず,流行の最初から最後の患者まで,同じ有効性で治療できるという特性4)は,致死性感染症に対する抗ウイルス薬として理想的である。
5. アビガンの使用上の注意と承認条件
アビガンは承認に至るまでに,考えうる種々の毒性試験が行われている。動物実験において初期胚の致死および催奇形性が認められたので,医薬品医療機器総合機構(PMDA)と米国食品医薬品局(FDA)の薬理や毒性の専門家たちから,多くの動物での安全性試験が求められ,実施された。健常人に対する毒性の懸念があれば,アビガンを薬剤として認めず,ヒトでの臨床試験をさせない選択肢もあったが,両機関は動物での安全性試験のデータから,妊孕性以外に問題がないと判断し,ヒトでの第Ⅰ相試験が始まった。動物実験では精子の減少が認められたが,ヒトでの試験では影響がないことが確認された。
動物実験において初期胚の致死および催奇形性が認められたことによって,承認時には,胎児に障害を起こす可能性を排除するため,妊婦または妊娠している可能性のある女性への投与が禁忌となった。そして添付文書には,投与期間中および投与終了後7日間はきわめて有効な避妊法の実施を徹底することが注意喚起されている。こうした対応により,新たな薬害の発生を防ぐことができると考えている。
このほかの副作用については,上記の国内臨床試験および国際共同第Ⅲ相試験で重篤な副作用や後遺症は認められていない。胎児への影響に注意すれば,致死性RNA感染症をアビガンで治療することは問題ないと考えている。ただ,妊婦を避けたとしても,それ以外の予期せぬ重篤な副作用の出現を否定するものでないことは他の薬剤と同様である。
以上のことから,添付文書には,「本剤は,他の抗インフルエンザウイルス薬が無効又は効果不十分な新型又は再興型インフルエンザウイルス感染症が発生し,本剤を当該インフルエンザウイルスへの対策に使用すると国が判断した場合にのみ,患者への投与が検討される医薬品である。本剤の使用に際しては,国が示す当該インフルエンザウイルスへの対策の情報を含め,最新の情報を随時参照し,適切な患者に対して使用すること」と記載され,国が管理する薬剤として承認された。
2015年7月,台湾がアビガンの備蓄を決定し,17年3月には日本で200万人分の備蓄が決定して,現在に至っている。中国の研究では重症インフルエンザ肺炎の治療で,タミフル単独に比べ,タミフルとアビガンの併用療法が有意に良好な結果を得ている5)。
6. COVID-19に有効な可能性のある薬剤
COVID-19は現在,標準的治療薬はない。そこで中国の国家衛生健康委員会は,7万以上の薬物または化合物の中から5000の薬物候補を選択した。その後,従来のコロナウイルスに対して細胞レベルでテストし,最終的に,抗マラリア薬クロロキン,アビガン,エボラ出血熱の臨床試験で使用されたレムデシビルの3剤に絞り,臨床試験を始めた。このほかにも,治療候補薬の臨床試験が多数行われている。世界保健機関(WHO)は抗HIV薬ロピナビル・リトナビル(商品名:カレトラ)とレムデシビルの臨床試験を実施している。
(1)クロロキン
クロロキンは副作用として網膜症を起こすことから,現在わが国ではヒドロキシクロロキンが,皮膚エリテマトーデス・全身性エリテマトーデスの適応を有する。作用機序は不明であるが,臨床的な有効性があったと中国の国家衛生健康委員会が報告している。
(2)カレトラ
HIVプロテアーゼ阻害薬のカレトラは治療効果が期待されたが,十分な効果は確認されていない。重症COVID-19患者の有意な改善,死亡率の低下,ウイルス消失が認められなかった6)。さらに,アビガン群はカレトラ群に比べ,ウイルス消失が有意に早く,胸部CTの改善率が有意に高いと報告されている7)。
(3)レムデシビル
レムデシビルは,細胞培養レベルでは低濃度でエボラウイルスや新型コロナウイルスの増殖を抑えることから効果が期待される。ただ,エボラ出血熱に対しては,2種の抗体療法の方がレムデシビルより優れていたと報告されている8)。無治療群との比較はなく,抗体療法との比較なので,レムデシビルの有効性評価は難しいと思われる。COVID-19に対する有効性に関しては現在,中国をはじめとした国際共同治験等が進行中である。
(4)アビガン
アビガンに関しては,抗ウイルス活性濃度(EC50)がエボラウイルスと新型コロナウイルスで同じであることが報告された9)10)。このことは,細菌でいえば,大腸菌とブドウ球菌でMIC(最小発育阻止濃度)が同じであれば,同じ投与量で同様に効果があることを意味する。細胞培養レベルで効くことがわかれば,EC50値の大小は投与量が変わるだけで,有効性は維持される。
アビガンは新規の感染細胞には有効であるが,既感染細胞でウイルス産生を阻止する活性は低いので,ウイルスの成熟・拡散を阻害する薬剤と併用すると,有効な治療ができると思われる。先に述べたように,アビガンの耐性ウイルスができないという特性は,最初から最後の患者まで,有効な治療ができる点で優れていると思う。
先日,中国の深圳と武漢の病院からアビガンの有効性が報告された(表1,武漢の報告は査読前のものを公表)7)11)。試験対象者は,深圳では発症7日未満と早い一方,武漢は発症12日までのために肺炎が進行した患者がおり,深圳の方が成績が良いように見える。対照群は,深圳はカレトラ,武漢はarbidol(ウイルスの侵入阻害薬)。アビガンの投与量は初日1600mg×2,それ以降600mg×2/日(新型インフルエンザと同様)を,深圳では14日,武漢では7日間投与し,臨床効果を評価した。武漢では表1の結果に加え,解熱や咳緩和までを有意に短縮した(P<0.0001)。有害事象は尿酸値の有意の上昇を認めている。
深圳では本疾患で重要な肺の線維化や瘢痕化に関わる胸部CT所見の変化を観察した。胸部CT改善率は4日目と9日目で有意差はなかったが,14日目にアビガン群は91.4%と有意に改善した。これは胸部CT所見の改善であり,健常への回復ではないので,ウイルス性肺炎では後遺症を残す12)13)。
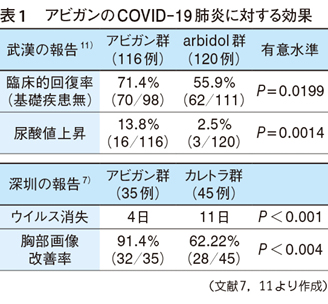
カレトラ群では,胸部CT悪化が9日で35.6%(16/45),14日で20%(9/45)である。中国ではCOVID-19患者のうち,重症肺炎患者の25%がICUに至っているが,この自然悪化率とカレトラ群の悪化率はほぼ同じといえる。一方,アビガン群では,14日での悪化は1例のみであるため,肺炎の重症化を阻止している意味は大きい。試験の対象が発症7日未満だと,肺炎が軽症で治療不要者を対象とする懸念があるかもしれないが,それよりも,肺の線維化や瘢痕等の後遺症を残さないことに意味があると思う。
COVID-19の発症6日までの早期治療は,肺炎による肺線維化や瘢痕化を最小限にして,死亡につながる肺炎重症化を阻止する。重要なことは,呼吸機能の予備能がない方々にいかに早期に対応するかであろう。
例えば,ウイルス感染症の帯状疱疹は,紅斑,水疱,膿疱,痂疲へと症状が移行するが,抗ウイルス薬の治療を開始するのは発疹出現時である。免疫応答により水疱ができてウイルス量がピークを過ぎるころから治療を開始しても大きな効果が期待できないからだ。
日本感染症学会の「COVID-19に対する抗ウイルス薬による治療の考え方 第1版」(2020年2月26日)では,抗ウイルス薬投与開始時期について「低酸素血症の発症」を必要条件としている。しかし,マウスのインフルエンザ肺炎では,この時期は抗ウイルス薬より,サイトカインと活性酸素による傷害を抗炎症薬や抗サイトカイン抗体(抗IL-6抗体)等14)により緩和する時期と思う。
なお,ここで,アビガンの治療効果を評価する時期について整理したい。COVID-19は,咽頭のウイルスは発症とともに検出される。ウイルス量は10日がピークで,12~15日で減少する。そして,鼻咽頭には症候性患者と無症状感染者も同等のウイルス負荷があるため,無症状感染者からの感染の可能性が報告されている15)。
このように,発症後約2週間でピークを終えウイルスが消失するというウイルスの基礎知識に基づいて,ウイルス消失時期にアビガンの治療効果を評価する必要がある。ただし重症例では,ウイルス増殖時間は長いと思われる。
(5)シクレソニド
わが国では,国立感染症研究所で分離した新型コロナウイルスに対して吸入ステロイド薬シクレソニド(商品名:オルベスコ)が抗ウイルス活性を示し,患者3名に使用した結果,効果が認められたと報告されている16)。このほか,わが国の症例報告は,日本感染症学会のホームページ「新型コロナウイルス感染症」に掲載されているので,参考にされたい。
COVID-19の治療薬に関しては,仮に今後,日本人全員が新型コロナウイルスに感染した場合,重症化率を10%と低く見積もっても,1000万人が使用する可能性があるので,耐性株出現を避ける使用法を目指す必要がある。
7. おわりに
COVID-19は,感染者の20%が重症肺炎となり2%が死に至る感染症である。したがって,身近に重症者が出る可能性が高いことから,抗ウイルス薬について実地医家の先生方が患者に説明できることを目的に本稿を作成した。前回(No.5004「新型コロナウイルス感染症(COVID-19)のウイルス学的特徴と感染様式の考察」)の考察と中国の臨床試験から,発症6日までにアビガン治療を開始すれば,ウイルスの早期消失,咳嗽の軽減,肺炎の進行や重症化が阻止され,それにより死亡率が激減するであろう。さらに,若年者でも肺炎の後遺症である線維化や瘢痕化を最小限にすることができ,将来の呼吸機能の低下が避けられる。テドロスWHO事務局長が“kill”という表現を使ったように,COVID-19に殺されないためには,ハイリスクの年齢であったり基礎疾患を有しているのであれば,労作性呼吸困難(息切れや呼吸回数の増加)により肺合併症を早期に発見して,胸部CTで肺病変があれば,発症後6日にはアビガン治療を開始していただきたい。呼吸機能に予備能のない方を除けば,患者のADLを保ち,人工呼吸器装着者は減り,医療崩壊に至る可能性がなくなることが期待できると考えている。
※著者の利益相反として,アビガンの開発にかかわり,アビガンを製造する富山化学工業(現富士フイルム富山化学)と共同研究を行ってきた。
【文献】
1) Furuta Y, et al:Antimicrob Agents Chemother. 2002;46(4):977-81.
2) Takahashi K, et al:Antivir Chem Chemother. 2003;14(5):235-41.
3) Takashita E, et al:Antiviral Res. 2016;132:170-7.
4) Shiraki K, et al:Pharmacol Ther. 2020:107512.
5) Wang Y, et al:J Infect Dis. 2019 Dec 11
6) Cao B, et al:N Engl J Med. 2020 Mar 18.
7) Cai Q, et al:Engineering. 2020 Mar 18.
8) Mulangu S, et al:N Engl J Med. 2019;381(24):2293-303.
9) Oestereich L, et al:Antiviral Res. 2014;105:17-21.
10) Wang M, et al:Cell Res. 2020;30(3):269-71.
11) Chen C,et al:medRxiV.2020 Mar 17.
12) Lau AC, et al:Respirology. 2004;9(2):173-83.
13) Ooi GC, et al:Respirology. 2003;8 Suppl:S15-9.
14) Evaluation of the Efficacy and Safety of Sarilumab in Hospitalized Patients With COVID-19.
[https://www.clinicaltrials.gov/ct2/show/NCT04315298]
15) Zou L, et al:N Engl J Med. 2020;382(12):1177-9.
16) 岩渕敬介, 他:COVID-19 肺炎初期~中期にシクレソニド吸入を使用し改善した3例.
[http://www.kansensho.or.jp/uploads/files/topics/2019ncov/covid19_casereport_200310.pdf.]














































