お知らせ
特集:新型コロナワクチン 今わかっていること まだわからないこと


1998年京都大学医学部卒業。2002年北海道家庭医療学センターでの家庭医療研修を修了。以後,各地の診療所等に勤務。2017年検疫官に任官。

1. 新型コロナワクチン接種開始にあたって
2020年1月10日に中国保健当局が新型コロナウイルス遺伝子の全塩基配列を公表したその日から,世界中でワクチン開発レースが始まった。それからわずか11カ月後の同年12月に,ファイザー社1)(米国),モデルナ社2)(米国),アストラゼネカ社3)(英国)が相次いで英文査読誌に治験第3相の論文を掲載した。いずれも驚くべき高さの効果と安全性が示されており,世界はワクチンによる新型コロナ収束に光明を見出すこととなった。
しかし,「ウイルス遺伝子を人体に接種する」という新規の技術による開発であり,医師医療職の間ですら安全性に漠然とした不安を上げる声が少なくない。
本稿では2021年2月17日現在で筆者が把握している最新の情報に基づいて,3社の新型コロナワクチンの効果,安全性,接種時の検討事項,未検証項目および全般的注意点について整理した。上梓されて日が浅いワクチンであり,今後も頻繁な情報更新が予想される。筆者は個人で運営するウェブサイトにおいて常時情報を更新している。関心のある方は記事末尾に示したURLからアクセスされたい。
なお,本稿および筆者ウェブサイトの内容はすべて筆者個人の見解であり,所属組織を代表するものではないことに留意されたい。
2. 新型コロナワクチン開発の経緯
1. 既存のワクチン製法と新興病原体における限界
ワクチンの歴史は18世紀末のジェンナーによる種痘までさかのぼる。近代までに数種類の製法が確立されたが,いずれもワクチン製剤の主成分は抗原(弱毒生株を含む)であることに変わりはない。抗原は当然のことながら,研究室または製薬工場で生産される。その2大製法が,生(弱毒生)ワクチンおよび不活化ワクチンである。
生ワクチンは,病原体を種々の条件で継代培養し,病原性がきわめて乏しいが免疫原性は十分な株を分離して利用する。しかし,ワクチンに適した株は偶然の産物であり,開発着手から実用化までの時間が見通せないばかりか,適切な生株が分離されるか否かも予測困難である。2021年2月11日現在,新型コロナの生ワクチンで治験第3相まで進んだものは1つもない。
不活化ワクチンは,病原体を物理化学的に破壊して病原性を失わせ,断片化した菌体を抗原として利用する。多数の不活化ワクチンが実用化されているが,原料としての病原体を大量培養する生産技術の確立が必須である。新型コロナウイルスの大量培養系の確立には結果的に時間を要し,2021年2月11日現在ではようやく治験第3相に進んだ製剤が数種ある段階である。
生ワクチンも不活化ワクチンも,開発着手から実用化までに数年かかるのが通常である。
2. 新たなワクチン製法―mRNAワクチンとウイルスベクターワクチン
既存製法よりも開発スケジュールを短縮すべく,新たなワクチン製法が研究されてきた。ファイザー社,モデルナ社のmRNA(メッセンジャーRNA)ワクチン,およびアストラゼネカ社のウイルスベクターワクチンはその代表である。
mRNA4)ワクチンは,病原体遺伝子のうち免疫原性のある病原体抗原(表面蛋白など)をコードする塩基配列を基にヒト細胞が利用できる形のmRNAを組み上げ,人体に接種する。
通常は筋肉注射され,接種後に筋肉の細胞(筋細胞)が速やかにmRNAを取り込んで標的抗原を細胞質にて産生し,細胞外へと放出する。放出された標的抗原を免疫細胞が認識することで獲得免疫が成立する。ヒト用ワクチンで実用化されたのは今回が史上初である。
ウイルスベクターワクチン5)は,病原体遺伝子のうち抗原をコードする塩基配列をほかのウイルスの遺伝子に組み込み,人体に接種する。用いるウイルスは当然のことながら,ヒトに感染はするが病原性はない無害なものであり,ベクターウイルスと呼ばれる。ベクターウイルスは「生」の状態で接種されるが,遺伝子操作で増殖能を欠失させることで体内での増殖は阻止できる。通常は筋肉注射され,ベクターウイルスは筋細胞内で組み込み遺伝子を放出し,以後はmRNAワクチンと同じ原理でヒト免疫系を賦活化する。ヒト用ワクチンではエボラワクチンとして実用化された実績がある。
どちらの製法も「ヒト細胞を抗原の生産場所とする」という点で,従来製法からの発想の転換がある。生株,不活化用株の研究室,製薬工場での生産確立に時間を費やさず,ヒト細胞を生産工場として利用する発想であり,遺伝子工学の発展成熟がもたらした技術革新である。
3. 1年未満での実用化は皮肉にも大流行がもたらした
まったくの新製法かつ病原体発見から1年未満という短期で実用化されたことから,「開発手順を省略した怪しいワクチン」という不信感が一部の医療者や市民にあると聞く。
今回の短期間実用化には,「短期間での製剤完成」と「短期間での治験完了」の2つの側面がある。短期間での製剤完成は,「標的抗原の塩基配列さえわかれば速やかに設計に着手できる」という遺伝子工学発展の恩恵による。
短期間での治験完了は,皮肉にも大流行そのものが理由である。治験で予防効果を検出するためには,実薬・偽薬両群で一定以上の感染者数が必要となる。開発国である米英が世界で一,二を争う未曾有の新型コロナ流行に襲われたことで治験参加者の感染者数がごく短期間で増加し,わずか3~4カ月の追跡期間で両群に有意な差が現れてしまったのだ。
当然のことだが,いずれの治験も米英当局の許諾と監視を受けながら正当に実施され,省略された手順などない。ごく短期での実用化は,遺伝子工学の発展と未曾有のパンデミックそのものが原因だと理解して頂きたい。
4. ウイルス遺伝子がヒト遺伝子に組み込まれることはあり得ない
「接種によって人体に入ったウイルス遺伝子がヒト遺伝子に組み込まれてしまい個体や子孫に遺伝学的な影響が出る」という不安ないしデマが世間で語られているようだ。
直接接種したmRNAであれ,ベクターウイルスを介して細胞内に生成されたmRNAであれ,元来きわめて不安定な物質である。体内では数分からせいぜい数日で分解され,長く生体内に残存することはあり得ない。-70℃での保管が必要な点からも不安定さは明らかである。
分子生物学のセントラルドグマを思い出してもらいたい。ヒト遺伝子DNAは,DNA→mRNA→蛋白質という一方向にしか処理されない。mRNAが逆流してDNAに再組み込みされる処理系をヒト細胞は持ち得ないし,逆転写酵素がワクチンに含まれるはずもない。
そもそも,ヒト細胞に種々のウイルスが感染するたびに,ウイルスの全遺伝子が細胞内に放出されてヒト細胞はそのコピーを大量生産させられている。ワクチン内のウイルス遺伝子がヒト遺伝子に組み込まれてしまうならば,それ以前に世界には「インフルエンザ人間」や「ノロウイルス人間」のような「ウイルスハイブリッド人間」が数多く誕生していなければ辻褄が合わない。
上記の不安はまさに杞憂であり,デマとして広がらないよう医療職から市民に適切に説明すべきであろう。
5. ワクチンの予防効果(VE)とは
ワクチンの治験はランダム化比較試験(RCT)で実施され,実薬群と偽薬群での感染リスクの違いを比較する。たとえば観察期間内に実薬群1万人中10人が感染し,偽薬群1万人中100人が感染したとする。偽薬群の感染リスク100/1万に比した実薬群の感染リスク10/1万の減少度合いは,(100/10000-10/10000)÷(100/10000)=0.9,すなわち90%である。この90%がワクチンの予防効果(vaccine efficacy:VE)である。EBM(evidence based medicine)用語での相対リスク減少(relative risk reduction:RRR)と同じ概念である。言い換えれば,「実薬を接種することで防ぎ得た感染者数の割合」である。
麻疹や風疹のようにワクチンの歴史が古く既感染者も多い感染症でのVEは,現代では検証しがたい。比較的新規のワクチンでは,小児肺炎球菌でVE 90~100%,帯状疱疹(組み換え蛋白)で97%,ヒトパピローマウイルスで90%超(子宮頸部前がん病変の予防)である。季節性インフルエンザワクチンのVEは流行株との一致性により変動するがおおむね50%前後である。
3. 世界での新型コロナワクチン接種状況
米New York Times紙の「Coronavirus Vaccine Tracker」6)によると,2021年2月11日現在で世界の計58カ国が計10製剤に対して正式承認または緊急使用承認を与え,国民への接種を開始している。
同日現在で既に総計1億6000万人が少なくとも1回の接種を受け,世界人口の2.1%に達している。最速のイスラエルは人口890万人の実に70%,アラブ首長国連邦では960万人の51%が少なくとも1回の接種を終えた。イスラエルは2回完遂者が43%である。米国,英国はそれぞれ3億3000万人の15%(完遂11%),6700万人の22%(完遂0.8%)が接種済みである。
4. わが国で使用が見込まれる新型コロナワクチン3製剤
各国から2カ月遅れの2021年2月12日10時過ぎ,ベルギーの工場から出荷されたファイザー社の日本向けワクチン第1便が成田空港に到着した。同日中に厚生労働省の大臣諮問機関である薬事・食品衛生審議会(医薬品第二部会)7)が特例承認を可として答申,厚生労働大臣が2月14日夜半,製剤名「コミナティ筋注」8)(以下,コミナティ)として承認した。わが国初の新型コロナワクチンである。なお,わが国では第1/2相試験のみが行われ,第3相試験は米国での成績を参照しての特例承認である9)。
コミナティを含め,表1の3製剤がわが国で使用される見込みが高い。このほかにも国内で治験を実施中または計画中の製剤が複数ある。
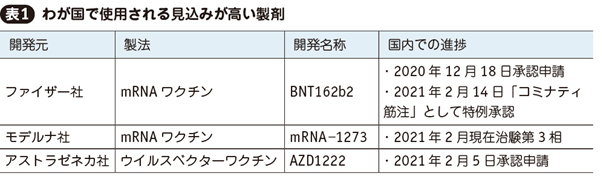
1. 3製剤の治験概要
ファイザー,モデルナ,アストラゼネカの3社は治験第3相でそれぞれ約4万人,3万人,2万人の参加者を登録した。年齢はファイザー社が16歳以上,ほか2社は18歳以上とし,高齢者も含まれている。妊娠や免疫抑制状態等の一定条件は除外された。糖尿病等の重症化リスクのある基礎疾患者は組み入れられ,全参加者の10~20%を占めた。
2. 3製剤の接種方法
ファイザー社のBNT162b2(コミナティ)は21日間隔で2回接種,モデルナ社のmRNA-1273およびアストラゼネカ社のAZD1222は28日間隔で2回接種である。ただし,AZD1222は治験期間中に初期ロットの検定不良が判明し,検定方法の見直し等に時間を要したことから,被験者によって2回目接種までの間隔が28日~12週間以上と大きくばらついた。
投与経路はいずれも筋肉注射(三角筋部)である。
◆筋肉注射の接種手技
筋肉注射で投与されたウイルス遺伝子から標的抗原を産生するのは筋細胞である。間違って皮下注射すると,薬液が筋細胞に到達せず免疫応答が十分生じないおそれがあり注意が必要である。
わが国では筋肉注射のみを投与経路とするワクチンが少ないことから,接種担当者が筋肉注射手技に習熟していない可能性もある。筆者が所属する日本プライマリ・ケア連合学会は,新型コロナ特設サイトに筋肉注射手技の解説を掲載している。是非参照して頂きたい。
▶ 日本プライマリ・ケア連合学会:新型コロナウイルス感染症(COVID-19)診療所・病院におけるプライマリ・ケアのための情報サイト
また,より安全な三角筋への筋肉注射手技について,仲西らの論文10)が非常に重要な論点を論じており,必ず参照すべきと考える。
3. 3製剤の効果(VE)
各治験では接種後一定期間以降の新型コロナ発症を一次エンドポイントとして,BNT162b2(コミナティ)およびmRNA-1273は重症化を二次エンドポイントとして,それぞれVEを評価した。表2の通りいずれのVEも高く,mRNAワクチンであるBNT162b2(コミナティ)およびmRNA-1273のVEは特に高かった。
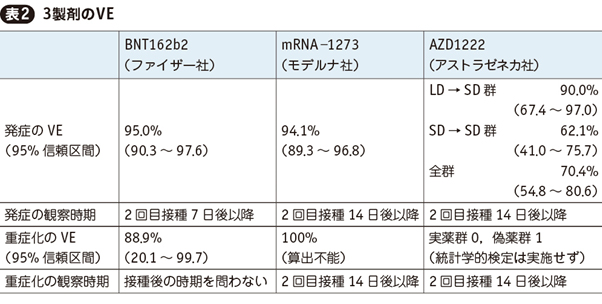
AZD1222については,治験中の初期ロット検定不良の影響により,1回目接種者の一部が計画よりも低用量の接種となってしまった。これをlow dose(LD)とし,本来の計画接種量をstandard dose(SD)として,治験を仕切り直した経緯がある。結果的に1回目をLD,2回目をSDで接種した群と,1・2回目ともSDで接種した群の2群が発生し,それぞれのVEと全群集計してのVEの3値が検証された。
4. 3製剤の有害事象
BNT162b2(コミナティ),mRNA-1273の治験では,ワクチンとして当然想定される反応性症状(接種部位の疼痛,発赤,腫脹等の局所症状および発熱,倦怠感,頭痛,関節痛等の全身症状)を個別に集計し,いずれも実薬群で偽薬群よりも多く検出された。アストラゼネカ社は治験論文には反応性症状の個別集計は掲載していないが,「治験期間中を通じて安全性指標は良好であった」と記している。
重症または重篤な有害事象は3製剤とも実薬群・偽薬群に差はなく,ワクチンと因果関係がある重篤有害事象は検出されなかった。
BNT162b2(コミナティ),mRNA-1273の主な反応性症状の実薬群での内訳を,コミナティとしての日本での治験結果も含めて,表3に示す。幅があるものについては,若年者のほうが多く,また2回目のほうが多い傾向にあった。
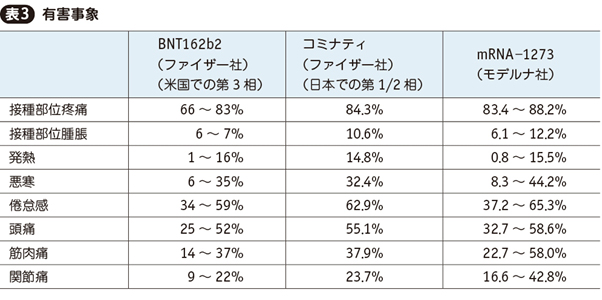
いずれの反応性症状も1日~1週間以内に自然軽快し,後遺障害の残存はない。
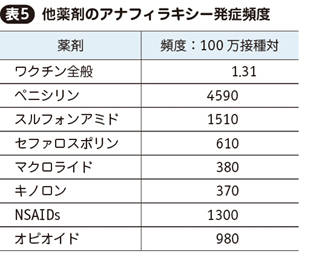
5. 3製剤のアナフィラキシー
3製剤とも治験においてアナフィラキシーは報告されなかったが,市中での接種開始後に米国11)12)および英国13)で一定程度の報告があった。これらの集計が表4の通りである。
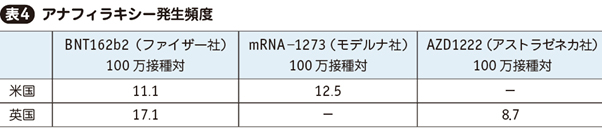
米国におけるワクチン由来のアナフィラキシー14)および他の薬剤によるアナフィラキシー15)の頻度は表5の通りである。3製剤はワクチン全般に比べれば若干高い頻度だが,高く見積もっても6~10万接種に1件程度であり,実診療で次々に発生するような頻度とは言えない。また他薬剤に比べて圧倒的に低い。
ワクチンを扱う以上はアナフィラキシーには常に万全の備えが必要だが,3製剤において過度におそれる必要はない。
なお,ワクチン,薬剤,食物のいずれのアナフィラキシーも,主成分だけがアレルゲンとは限らない。添加剤がアレルゲンのこともしばしばある。
ファイザー社のコミナティは,添付文書によると表6の成分が添加剤として含まれている。後半6成分は生体内物質またはごく日常的な低分子なので,アレルゲンとなる可能性はきわめて低い。注意すべきは前半3成分である。特にポリエチレングリコール(polyethylene glycol:PEG)は多種の薬剤(内服,外用ともに),化粧品等に含まれており,アナフィラキシー原因物質として知られている16)。PEG含有物によるアナフィラキシー歴があればコミナティ接種は禁忌となる。さらに,同じく多種の薬剤に添加剤として使用されているポリソルベートは,PEGと交差抗原性があるため,ポリソルベートによるアナフィラキシー歴もPEG含有製剤の禁忌となる。
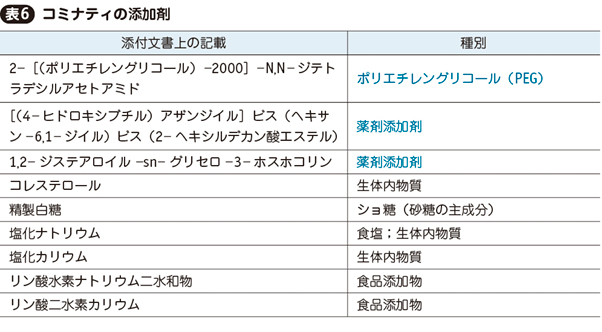
他の薬剤によるアナフィラキシー歴がある場合は,必ず当該薬剤の添加剤を添付文書または製薬会社に問い合わせて確認し,接種予定のワクチンの添加剤と照合せねばならない。共通する添加剤がある場合は,接種禁忌となる。
新型コロナワクチンと共通する添加剤を含まないほかのワクチンによるアナフィラキシー歴は接種禁忌とはならないが,ワクチンとして共通する未知の機序によるアナフィラキシーのリスクは十分に説明して同意を得た上で,接種後はより慎重に経過観察する必要がある。
ワクチンと共通する添加剤を含まない薬剤,食物等によるアナフィラキシーでは,ワクチンによるアナフィラキシーのリスクが特に上昇するとは考えられないため,通常通りの注意による接種が可能である。もちろん,本人の不安に丁寧に答える必要はあるし,緊急処置等の準備は必須である。
その他,アナフィラキシーではないアレルギー歴(花粉症等)においても,通常通りの注意で接種可能だが,緊急処置を準備すべきは言うまでもない。
6. 3製剤の接種の是非は
筆者は,喜んで接種を受ける。本稿脱稿時点ではまだ自分の接種日が決まっていないが,1日も早く受けたいと心待ちにしている。
前述した通り,3製剤とも2~4万人が参加した治験第3相試験において,新型コロナ発症予防のきわめて高い効果と安全性が示された。米英での接種開始後に判明したアナフィラキシー頻度も他ワクチンまたは他薬品に比べて許容できる頻度であり,世界で数千万人以上が接種を受けても現時点で因果関係が示唆される重篤有害事象は報告されていない。
5. まだわからないこと
■ 長期の効果は未確定
ワクチンの治験としては3製剤ともきわめて短期間に目標数に達しており,論文から読み取れる平均追跡期間は表7の通りである(論文中の人年および解析対象人数から逆算)。
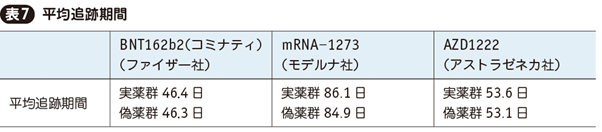
また論文中のKaplan-Meier曲線から読み取れる最長追跡期間はBNT162b2(コミナティ),mRNA-1273で110日台,AZD1222で80日台である。
すなわち,3製剤は治験では平均1.5~3カ月,最長でも3~4カ月までしか追跡できておらず,それ以降のVEは未確定であることに留意が必要である。
良いシナリオとして,数年~生涯にわたって高いVEが保たれると期待したい。しかし悪いシナリオとしては,接種後数カ月~数年の間に実薬群での感染者数が増加し,偽薬群との差が縮まっていくおそれも否定できない。どちらなのかは今後の長期成績を見極めるしかないのが現状である。
■ 変異株に対する効果は未確定
新型コロナウイルス自体は2~4週間に1回程度のRNA配列の変異を繰り返している。RNA配列の変異が蛋白の変異につながり,蛋白変異がヒトへの感染性等の変異につながるには,偶然が幾重にも重なる必要がある。2020年末以降,英国および南アフリカ共和国をはじめとして世界各地で発見されている各種の変異株は,偶然が幾重にも重なって,感染性や致死率17)を上昇させるという憂慮すべき変異を遂げている。
3製剤がこれら変異株の感染または発症予防に有効か否かは,感染者数等のtrue endpointではまだ検証されていない。in vitro研究として,変異RNA配列を組み込んだ人工ウイルスに対してBNT162b2(コミナティ)およびmRNA-1273の治験実薬接種者の血清が中和反応を示すか等を検証した研究が,プレプリント論文として数編発表されているのみである。表8に概要を示す。

ご覧の通りin vitroですらcontroversialな結果となっており,実際の感染予防効果は未確定と言わざるを得ない。しかし,接種による変異株へのデメリット(例:接種によって変異株により感染しやすくなる等)は理論的に考えにくいため,仮にVEが低下するとしても接種をためらう理由はないと言える。













































