お知らせ
[緊急寄稿]免疫抑制薬シクロスポリンが移植の分野に残した功罪─移植感染症学の視点からみたCOVID-19[第10章]


たかはし こうた●1974年,新潟大学医学部卒業後,東京女子医科大学を経て95年,新潟大学医学部泌尿器科教授。2010年新潟大学医歯学総合病院総括副院長。日本臨床腎移植学会理事長,日本臓器移植ネットワーク理事などを歴任。現在,新潟大学名誉教授,髙橋記念医学研究所所長,南千住病院名誉院長として医療の現場で活動している。ABO血液型不適合腎移植をわが国で初めて成功。新潟日報文化賞,日本腎臓財団大島賞,学術賞,2012年度日本医師会医学賞,文部科学大臣2014年度科学技術賞,2022年度日本サイコネフロロジー学会春木記念賞などを受賞

Point
シクロスポリン(CYA)はTリンパ球の機能を抑制する免疫抑制薬の1剤であり,その優れた薬効メカニズムにより移植免疫の分野を飛躍的に向上させた。
CYAは急性拒絶反応の発生メカニズムを明らかにし,その反応を抑制した。
CYAの特異性が移植患者にCYAの思わぬ副作用や有害事象をもたらした。
はじめに
一般健常人に発症する感染症は,宿主の生体防御機能がある,一定の基準の範囲で発病することを前提にしているので,病原体を中心に考えればよい。しかし,移植感染症においては,免疫抑制療法によって人為的にヒトの体に免疫操作を加えることにより,その宿主の生体防御機能の程度に差が生じるため,同じ病原体であっても,異なる病態や疾患を生むことがある。
新しい病態の可能性がある場合,病原体と生体防御機能の両面から,かつこれら2者の相対性をいつも念頭に置いて考えなければならない。まさにこの考え方で新型コロナウイルス感染症(COVID-19)の解明にあたれば,おのずとその解決策が見えてくる。
新興感染症の病態を知るためには,従来の感染症の既成概念を打破しなければならない場合もあり,移植感染症学をあらかじめ学んでおくとCOVID-19などの新興感染症の全貌を把握しやすい1)〜9)。
このように今までの枠組みを超えた自由な発想の転換を我々移植医にもたらしたのは,意外なことに1980年代に移植分野に画期的な変革を引き起こした免疫抑制薬シクロスポリン(CYA)である。今回は,CYAの功罪について考察を加えたい。
1. 免疫抑制薬シクロスポリンの誕生
CYAはノルウェーの南部ハルダンゲル高原の土壌から分離された土壌菌からの代謝産物である。1976年にスイス,サンド社のBorelが優れた免疫抑制効果があることを報告し,1978年,英国のCalneが初めて腎移植に臨床応用した8)〜12)。CYAと後に登場したタクロリムスは,その薬効メカニズムからカルシニューリン阻害薬に属する13)。
2. シクロスポリンの功罪
(1)シクロスポリンの功績
CYAの功罪のうち,その功績は何と言っても,急性拒絶反応の発生メカニズムを明らかにし,理論的にこの反応を抑制したことによる。それまで,拒絶反応の発症は,「臓器移植することにより,レシピエントの血中に移植抗原が入り,マクロファージ細胞がこの抗原を認識して,これを抗原提示細胞(APC)が……」と,理路整然と言われてきたが,この理論は臨床の免疫抑制療法にはなんら役に立たなかった。
CYAが従来の非特異的な免疫抑制薬アザチオプリンと大きく異なることは,選択的にhelper Tリンパ球の機能を抑制する作用点であり,メカニズムから考えると分子標的薬の走りと言える。そして急性拒絶反応の原因となるTリンパ球の機能と増殖を抑制することによって,その反応をほぼ制圧できたと言っても過言でない。
しかし,このじゃじゃ馬のような薬剤を乗りこなすには,移植医にも当然それなりの覚悟が必要であった。CYAの薬効メカニズム,薬剤の代謝,投与時期,血中治療域(therapeutic window),薬物相互作用,副作用および有害事象の腎障害や感染症など,多彩な知識を吸収する柔軟な頭脳が求められた。
①シクロスポリンの至適投与法
TDM(therapeutic drug monitoring),AUC(area under curve),PK-PD(pharmacokinetics-pharmacodynamics)study,bioavailability,trough値,drug interaction,cytochrome P-450など,学生時代の薬理学で学んだはずの聞きなれない横文字は臨床医にとって無縁と考えていたが,卒業して十数年目にしてその知識を要求されるとは意外であった。すなわち,今までの経験による匙加減の薬剤投与法時代からの離別を意味し,薬剤の投与法が科学的に裏付けられた投与法に進歩した。
これらの薬理学のマーカーを駆使し,CYAの狭い至適血中濃度治療域に合わせて逆算して服用量を決めて患者に投与をすれば,拒絶反応は抑制され,副作用や有害事象を最小限にとどめることが可能になった。
1986年,カルシニューリン阻害薬の効果と副作用,有害事象,特に腎障害を抑制するため,TDMの役割が重視され,その目的を達成するためにシクロスポリン研究会が発足した。さらに,Ciclosporin Pharmaco-clinical Forum(CPCF)に発展させ,わが国の約150腎移植施設が参加し,CYA血中濃度の精度管理,つまり移植分野にTDMの概念を導入した。また,この薬剤の血中濃度測定が保険収載されると,全国どこの腎移植施設でも質の高い腎移植を国民に提供できるようになり,CPCFは現在では発展的解消している。
CYAの臨床応用により急性拒絶反応の発生率は低下し,短期成績は飛躍的に向上した。その結果,急性拒絶反応の発生頻度は従来の免疫抑制療法の1/3,ステロイド使用量も1/3,それに伴い患者の入院期間も1/3になったため,各移植施設の症例数は右肩上がりに増加した。
しかし,副作用として腎障害の大きな課題が残り,また長期成績では従来の免疫抑制療法とさほど変わりがなかった。カルシニューリン阻害薬が臨床応用される以前では拒絶反応の発生率はきわめて高く,移植腎機能障害のほとんどの原因が拒絶反応によるものであった。これらの阻害薬の登場により,激しい急性拒絶反応の発生が少なくなったが,その代わりにその影に隠されていた移植腎の機能を阻害する原因として再発生腎炎,de novo腎炎,薬剤による腎障害,BKウイルス腎症などの発生もみられるようになったため,移植腎病理の重要性が高くなった。そこで1997年に筆者を含む4人の医師が移植腎病理研究会を立ち上げ,発足以来,現在も日本臨床腎移植学会総会のサテライト・セミナーとして病理標本を見ながら年1回の学術集会が開催されている14)。
これらのCYAや国産の免疫抑制薬タクロリムス(プログラフ®)の研究に比べて,抗ウイルス薬,特に国産のファビピラビル(アビガン®)の治験はきわめてあいまいであり,そのあり方は見識を疑う。なぜなら科学から著しく外れているからである15)。
②ファビピラビル(アビガン®)に対するコメント
ここで,本稿の主題から外れるがファビピラビルについてコメントしたい。ファビピラビルは新型インフルエンザウイルス感染症で既に承認が下りている薬剤であり,国が管理している数少ない薬剤である。この薬剤がCOVID-19にも有効で適応拡大ができるかという点を以下に述べる。本薬剤は国産品であり,国益,国策,および国民の健康・福祉にかかわる大きな問題をかかえている。移植領域と異なり,その母集団が比べにならないほど大きい。
国立感染研究所の1グループは,ファビピラビルの有効血中トラフ濃度240μmの約1/4の64μmまでしか検査していないにもかかわらず,第94回日本感染症学会総会(2020年8月)でファビピラビルはCOVID-19には有効でないという結論を出して発表している。これが後に大きな波紋を呼んだ。本薬剤の有効性の評価については社会の関心が高く,広く説明が求められることを鑑み,さらに人類の生存を脅かすCOVID-19に対する治療薬が限られているので,医学界をはじめ国民の期待に添えるかを明らかにする必要性がある。そのためには,全国の医学部ウイルス学講座やウイルス研究所,薬理学講座および検査施設に声をかけて検査を求めるべきであった。また,このような世界のパンデミックを左右する薬剤は,CYAと同様に1施設で決めるべきでない。
また,厚生労働省主導の治験として観察研究を全国約800施設で約1万5000例に施行し,2021年12月28日に終了しているが,いまだにその解析結果が公表されていない。
急性ウイルス感染症における抗ウイルス薬の有効投与期間が,慢性ウイルス感染症や細菌に対する抗菌薬と大きく異なる点は,その効果が期待できる投与期間がきわめて限定されることである。すなわち,ウイルスの増殖を抑制するためには,予知診断としてウイルス検査陽性の時期から発症早期まで,患者のウイルス量が一番多い時期に投与しなければ,その効果は得られない。この観察研究のデザインにおいて,投与時期や主要評価項目がどのように決定されたか筆者にはわからないが,入院期間の短縮などの評価項目は,本来参考程度にしかならない。あくまで主要評価項目は,患者のウイルス(量)の有無,すなわち,陽性から陰性になるまでの期間の短縮である。
解析結果の公表がここまで遅れていると,COVID-19に有効な新薬が続々市場に出回るのを見計らってから,その成績を発表せざるをえない理由が何かあると疑いたくもなる。ウイルス検査を受けCOVID-19と診断され,なんら抗ウイルス薬の投与も受けず,自宅待機され亡くなった患者の無念や遺族の悲しみを考えるときわめて遺憾である。筆者は第6波の流行の波が今までの第5波までの波よりきわめて高い理由として,オミクロン株の感染力の強さだけではなく,ファビピラビルの観察研究を中止したことも要因のひとつになっていると推測している。
(2)シクロスポリンの罪
CYAは我々人類に素晴らしい贈り物を提供してくれた。しかし,その反面,Tリンパ球への特異的機能抑制のため,我々は今まで遭遇しなかった有害事象を経験させられた。そして,そのメカニズムが明らかにされるまで,世界的に多くの患者が不幸な転帰を辿った。
①ABO血液型不一致腎移植でみられた致命的な自己免疫性溶血性貧血
CYAを使用開始してから約1年後の1984年2月の寒い夜中2時頃,病院から自宅に1本の緊急電話がかかってきた。1週間前にO型のドナーからAB型のレシピエントに腎移植して,その後の経過が順調な婦人が突然ショックに陥り,意識がなくなったと言う。Ht値が11.7%と高度な貧血であるので,筆者の脳裏にまず浮かんだことは消化管からの出血だった。しかし,主治医はそれを否定した。尿がポートワイン状の色調をして,採血した血液が溶血しているというので,筆者はさっそく駆けつけて,対症療法として血漿交換と輸血をしたが,原因がわからないまま患者の意識は戻らず静かに亡くなった。その後,筆者の施設をはじめ国内外の移植施設でも同じような症例が報告された。当時,CYAそのものの副作用によるものと考え,ある薬理学教室に検査を依頼したが,その結果,薬剤による溶血性貧血は否定された。
その後,ドナーとレシピエント間のABO血液型不一致例の4例で溶血性貧血を発症したが,早期治療を実施したため事なきを得た。しかし,その原因は明らかにできなかった。不安を抱えたまま,そうこうしているうちに同年,Mangelらは溶血性貧血のメカニズムを明らかにした。CYAは選択性に優れ,Tリンパ球を抑制するが,Bリンパ球は抑制しない。その結果,移植臓器に抑制されず,残存したドナー由来のO型のpassenger Bリンパ球がレシピエントの血中に入り増殖する。やがて増殖したBリンパ球はO型由来のリンパ球であるので,抗Aまたは/および抗B抗体を産生し,1週間前後に抗体価が上昇し,レシピエントのAB型の赤血球と抗原抗体反応を起こすことにより,溶血性貧血を引き起こすことを報告した(図1)15)〜17)。
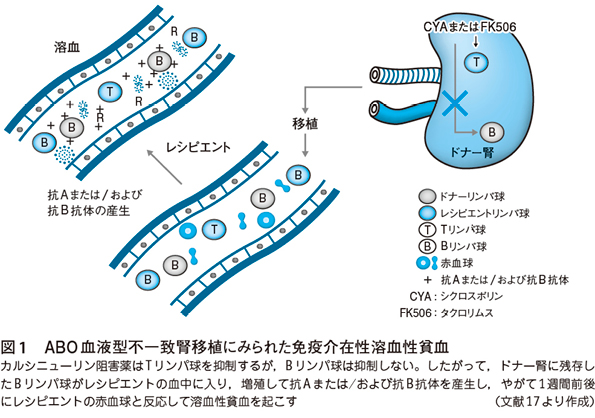
そのため,予防策として,ABO血液型不一致例(O型→A・B・AB型,A型→AB型,B型→AB型)の移植の場合には,リンパ球は放射線に感受性が高いので,移植後直ちに移植腎部に局所照射を実施し,さらに免疫抑制療法に特異性のない従来の免疫抑制薬アザチオプリンを加えることにした。それ以来,溶血性貧血は発生していない。当時はこれ程までにCYAがTリンパ球を特異的に抑制する薬剤とは思いもしなかった16)。
②その他の重篤な副作用と有害事象
CYAの重篤な副作用と有害事象として腎障害や白質脳症なども挙げられるが誌面の都合で今回は割愛させて頂く。
ウイルス性,特にサイトメガロウイルス(CMV)や新型コロナウイルス(SARS-CoV-2)によって惹起される自己免疫介在性炎症性疾患のひとつである間質性肺炎については,今まで繰り返し述べてきたので参考文献を参照して頂きたい1)〜7)18)
新規薬剤が上市されるとき,その薬剤のメリットばかり強調される傾向がみられるが,新薬,特に特異性の高い分子標的薬剤やモノクローナル抗体などは効果が優れている一方,免疫機構に働くので,治験時に経験したことがない致命的な副作用や有害事象が発生する場合があるので,十分な配慮が必要である19)20)。
おわりに
今回は,1978年に新規免疫抑制薬として臨床応用されたCYAが医学・医療の概念をいかに進歩させたか考察を加えた。
【文献】
1)高橋公太:医事新報. 2021;5064:26-32.
2)高橋公太:web医事新報. 2021.
https://www.jmedj.co.jp/journal/paper/detail.php?id=17678
3)高橋公太:医事新報. 2021;5083:38-46.
4)高橋公太:医事新報. 2021;5092:27-33.
5)高橋公太:日臨腎移植会誌. 2021;9(1):44-56.
6)高橋公太:腎と透析. 2022;92(2):222-34.
7)Borel JF, et al:Agent Action. 1976;6(4):468-75.
8)Calne RY, et al:Lancet. 1978;2(8104-5):1323-7.
9)高橋公太, 他:腎と透析. 1984;17:57-65.
10)高木 弘, 編:シクロスポリンの臨床. 医歯薬出版, 1989.
11)高橋公太, 編:腎移植における免疫抑制療法. 日本医学館, 1998.
12)Ochiai T, et al:Transplantation. 1987;44(6):734-8.
13)両角國男, 他, 編:シクロスポリンと腎─腎病理組織アトラス. 東京医学社, 1991.
14)白木公康, 他:医事新報. 2020;5036:30-7.
15)Mangel AK, et al:Transfusion. 1984;24(3):201-5.
16)水口 潤, 他:腎と透析. 1984;17:968-70.
17)Takahashi K:Accommodation in ABO-incompatible kidney transplantation. Elsevier, 2004.
18)高橋公太, 編:臓器移植におけるサイトメガロウイルス感染症. 日本医学館, 1997.
19)橋公太, 編, 太田和夫, 監:新しい免疫抑制剤─抗リンパ球モノクローナル抗体. 医歯薬出版, 1991.
20) 高橋公太:腎と透析. 2020:89(4):735-43.