お知らせ
アルツハイマー病の期待の新薬 お金に見合う価値は?[提言]

〔要旨〕早期アルツハイマー病の新薬,レカネマブが,米国につぎ日本でも承認されたが,臨床効果については国際的に疑問視されており,追加のエビデンスが不可欠である。経済評価の点でも問題を抱えており,米国ICERなどの非営利研究機関からは,費用対効果が良くないと評価されている。
1 夢の新薬?
アルツハイマー病の進行を遅らせる可能性があるという,期待の新薬「レカネマブ」(レケンビ®)が,米国食品医薬品局(FDA)で「迅速審査」後,本格審査により本年7月,国際的に初めて承認された。これについで,日本でも厚生労働省の専門部会の「優先審査」(審査期間を短縮)により了承され,9月に承認された。これに反して,その他の国では,英国,カナダなどで審査が継続されている段階である。

日本では製造承認後,医療保険で利用するために,薬価(公定価格)が年内にも決定される見込みである。現在の薬価制度1)のもとでは,画期的な新薬は原価計算(開発・製造費,営業利益などの積み上げ)が基本となるであろう。また,その他の評価(類似薬効方式)を利用する可能性もある。ただ,国際的に「お金に見合う価値」,すなわち経済評価が不可欠となってきているため,日本でも試行期間を経て2019年より「費用対効果」の評価制度による調整が導入されている(簡単に言うと,1年健康で長生きさせる費用が500万円以下となるように調整する)。なお,米国では公定価格はなく自由薬価であるため,レカネマブについては売り手の製薬企業が,年間1人当たり薬剤の価格を約390万円に設定している。
2 ベネフィットとリスク
まず,薬価を決める前提はレカネマブの臨床効果が真実かどうかということである。効果が不明であったり有害であったりすると,有害無益なものを効率的に配布することになるので,見せかけの経済評価をしてはいけない2)。そこで,レカネマブの臨床試験の結果3)を見てみよう(表1)。主要項目である認知機能の点数(CDR-SB)はわずかに改善するのみであり(18点満点中の0.45点),統計的に有意であっても臨床的な意味がないのではないかと,大きな論議を呼んでいる4)5)(そもそも,1つの項目をレベルで点数化し,さらに異なる6次元の項目の点数を総計することは誤りである)。
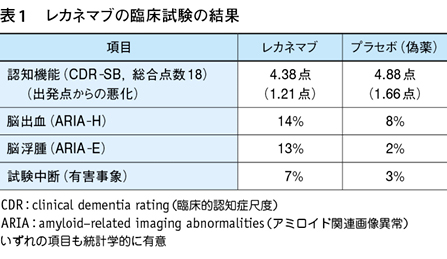
有害事象として,レカネマブ群は対照群に比べ,脳出血が約2倍,脳浮腫が約7倍多かった。また,レカネマブ群では有害事象などの原因により試験の追跡から脱落したものが7%もあり,それを考慮すると,認知機能の差がなくなる可能性が高い。さらに,点滴の反応や検査結果などから,〈目隠し〉(ブラインディング)が崩れている可能性も高い。これらをみると,レカネマブの健康利益はリスクを下回っていることが疑われる。そもそもこの薬剤はアルツハイマーの原因としてアミロイドβを想定しているが,それが低下しても認知機能は改善せず,原因としては疑問視されている6)。
承認には追加調査により疑問点を解決しておくこと(エビデンスの開発)が強く求められる。それが行われず,迅速な審査・承認が行われたことが問題である。その背景として,米国では製薬企業の影響力(圧力)が強く,FDAは問題のある薬剤を数多く承認していることが指摘されている。というのも,1つにはFDAの薬剤部門の予算の75%が企業から出されており7),しかも企業と専門家,FDAの癒着も指摘されている8)からである。一方,わが国の薬剤の優先審査・承認の問題はまだ検討されていない。ただ,従来,薬事・食品衛生審議会や中医協(中央社会保険医療協議会)の委員の企業との利益相反が問題となっている9)。近年,利益相反を報告するようになってきたが,厳密な第三者機関による厳しい包括的なチェックが必要であろう10)。

残り3,082文字あります
会員登録頂くことで利用範囲が広がります。 » 会員登録する