お知らせ
腸内細菌叢の臨床活用に向けて[最新論文で学ぶ 腸内細菌叢の臨床活用(1)]
腸内細菌叢とは
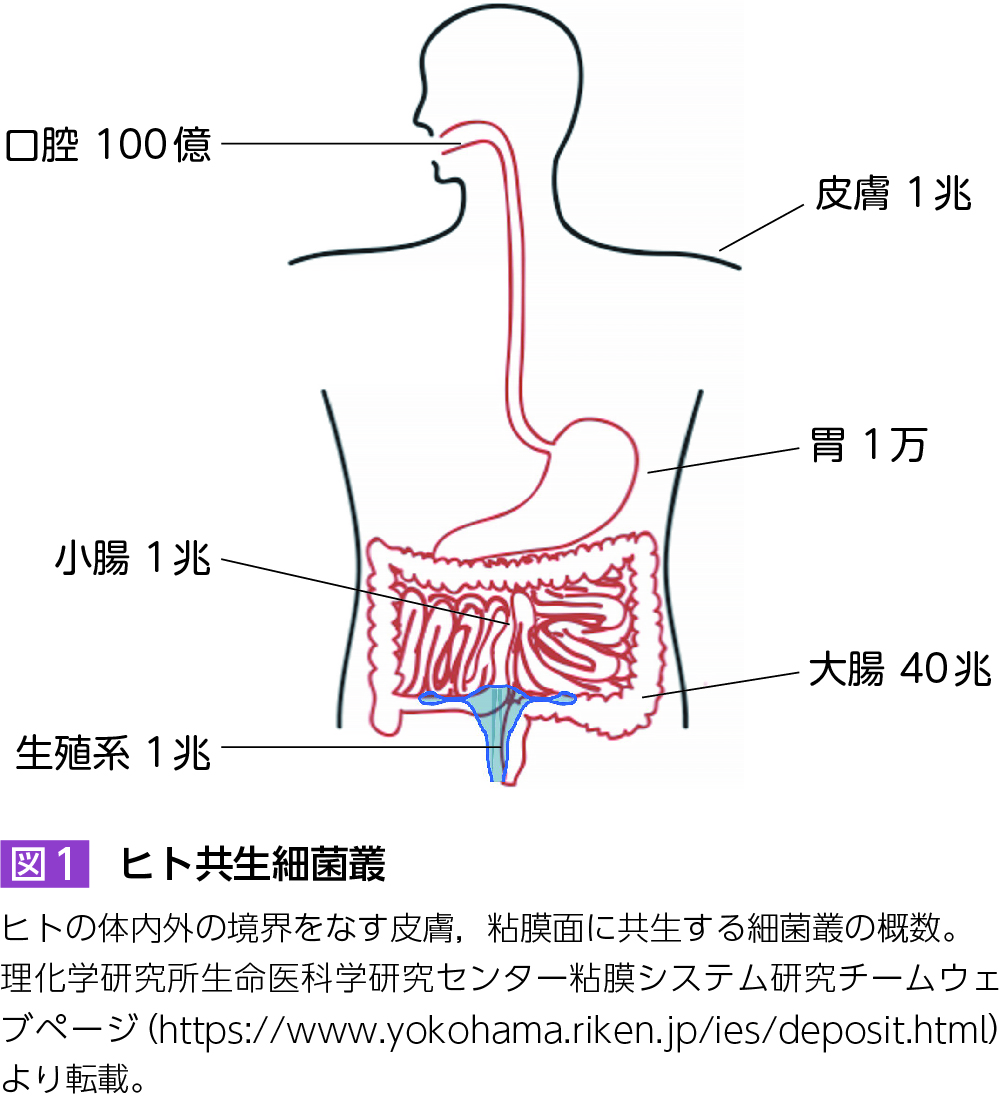
地球上で最初に誕生し,最も繁栄している生命体は細菌であり,地球上のあらゆる環境に適応して生息している。それはわれわれヒトを含む動物のからだも例外ではなく,外環境との境界をなす皮膚や粘膜面には多数の細菌群,共生細菌叢が定着・生息している。腸管内に共生・定着する細菌群は腸内細菌叢と呼ばれ,特に大腸に多く,ヒトの成人では40兆個以上と,成人の人体を構成する約30兆個とされる体細胞数より多い1)(図1)。さらに,腸内細菌叢は数百〜千種類の様々な異なる細菌群から構成され,その総遺伝子数は約100万にも及び,約2万とされるヒトの遺伝子数をはるかに凌駕している。したがって腸内細菌叢は全体として非常に複雑な代謝系を構成し,ビタミン類や必須アミノ酸などの宿主が産生できない栄養素を供給するほか,宿主との相互作用により,その生理・病理に多大な影響を与えている。
メタゲノム解析
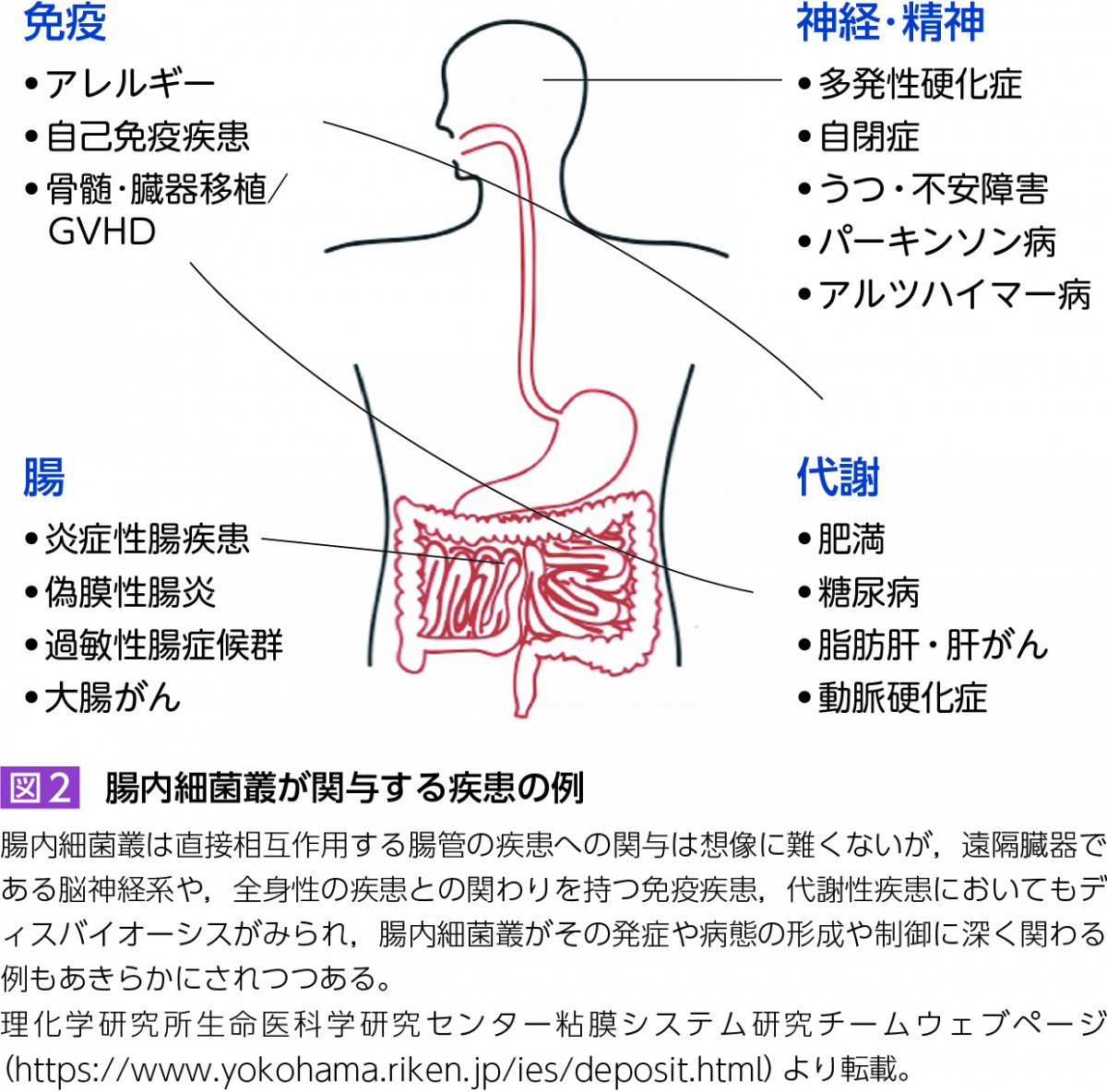
次世代シークエンサーの登場により,ある環境中に存在する細菌叢・微生物叢からそのままゲノムDNAを抽出し配列解析することで,微生物叢が持つ遺伝子の総体を明らかにする「メタゲノム」解析手法が開発された。その結果,疾患患者群と健常群とのメタゲノム比較解析が世界中で行われるようになり,様々な疾患において,腸内細菌叢の組成が健常者と異なる「ディスバイオーシス」を呈することが明らかにされてきた(図2)。多くの疾患におけるディスバイオーシスの特徴として,多様性の喪失がある。健常な腸内細菌叢は多種多様な細菌種の集合体であるが,疾患ではしばしば1ないし少数の細菌属,細菌種が優勢となり,多様性の喪失が認められる。
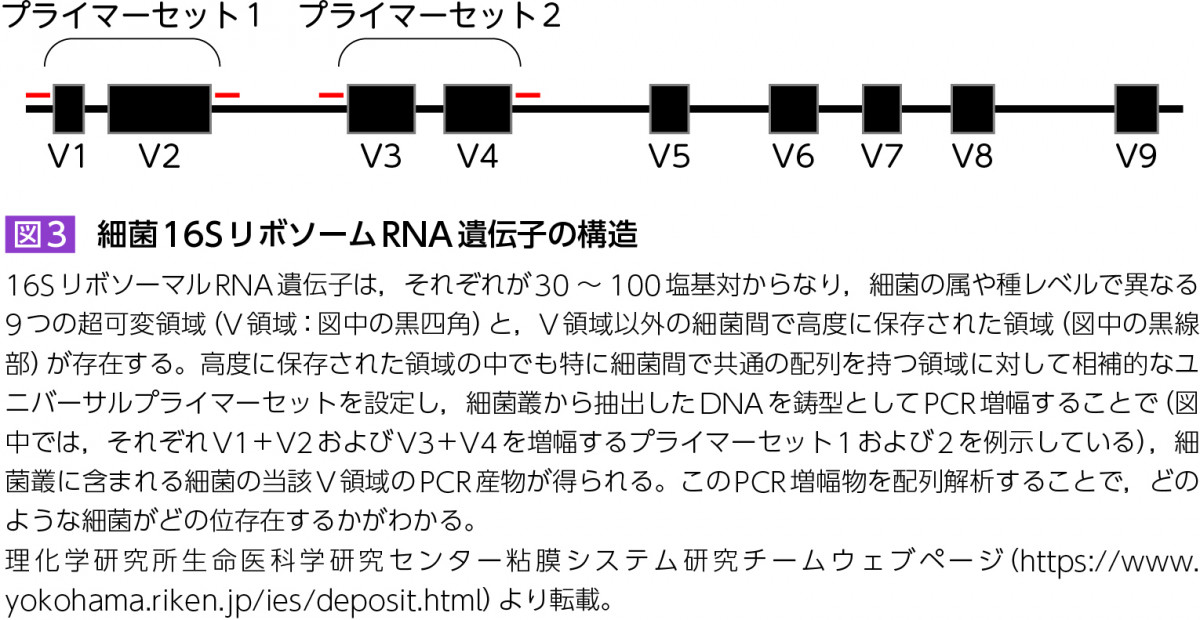
メタゲノム解析には大きく2つの手法がある。1つは,細菌の遺伝学的分類に用いられる16SリボソーマルRNA遺伝子(図3)の一部をPCRにより増幅し,その増幅断片に対して配列解析を行う16Sアンプリコン配列解析である。また、もう1つは,抽出したゲノムDNAをある程度の長さに断片化し,それらをそのままシークエンサーによる配列解析に供する,ショットガン配列解析である。
16Sアンプリコン配列解析では数百塩基対の短い断片配列から,どのような細菌がどのくらい存在するかという細菌叢の組成解析が可能である。対して,ショットガン配列解析では細菌叢の組成のみならず全体としてどのような遺伝子を有するか,さらに細菌のロングリード解析では1度に数千〜十数千塩基対の配列解析が可能となったことにより,完全長の細菌ゲノムの再構築が可能となった。どのような細菌がどの位存在し,それらがどのような遺伝子を有しているかが明らかとなる。
しかしながら,ショットガン配列解析では1検体当たりを分析するためにかなりの費用がかかる。16Sアンプリコン配列解析は,1検体当たりの費用がそれと比較して安価である。したがって,全検体を16Sアンプリコン解析に供し,その中から代表的な検体を抽出してショットガン配列解析により詳細に解析する,といった手法が薦められる。
しかし,このようなヒトでの研究では,ディスバイオーシスが疾患の原因か結果かの因果関係は不明である。そこで,マウスなどの動物試験による検証研究が重要となる。特に,帝王切開したマウス胎児を無菌飼育可能なアイソレーターという装置に無菌的に搬入・飼育する「無菌マウス」や,単離培養されて性状が明らかにされた部生物のみを無菌マウスに定着させた「ノトバイオート」マウスは有用な研究ツールとなる。
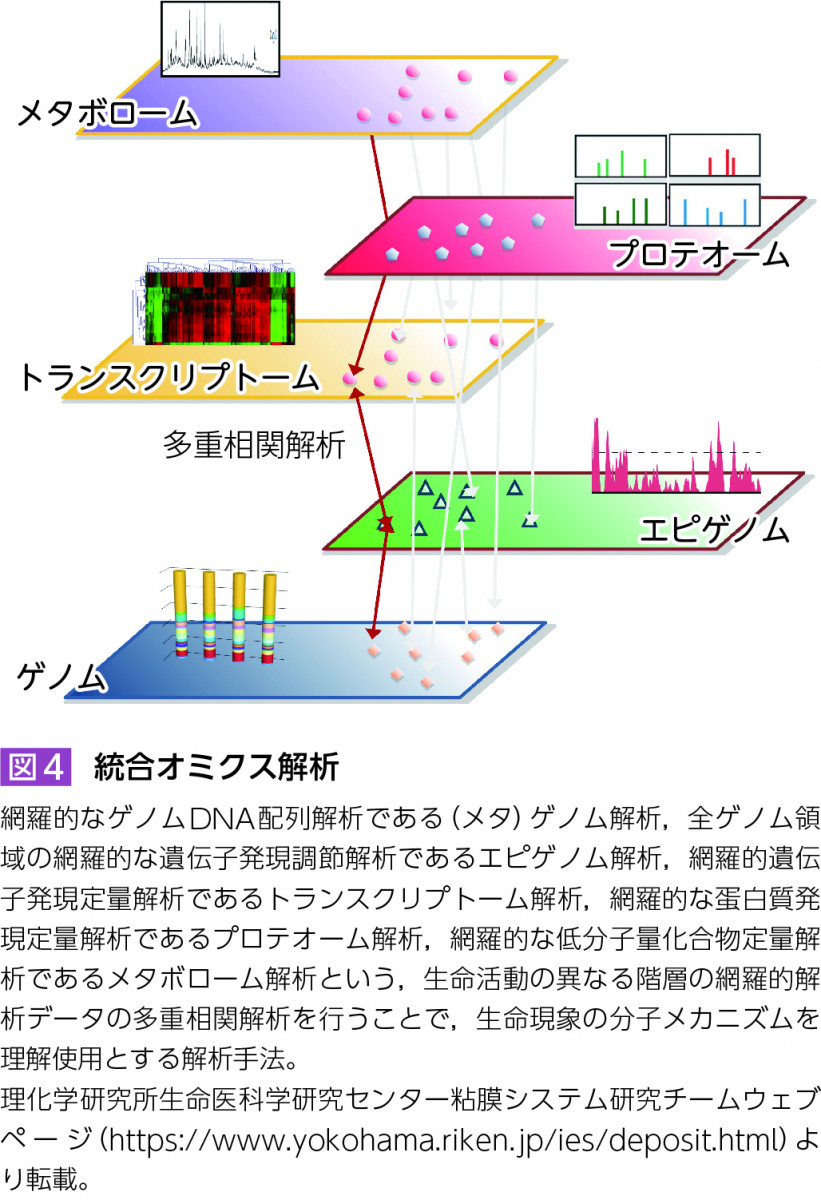
また,メタゲノム解析は遺伝子のカタログ作りであり,それだけでは宿主の生理機能や,疾患の発症や病態との関連には直結しない。そこで,メタゲノム解析に加え,網羅的遺伝子発現制御解析であるエピゲノム解析,網羅的遺伝子発現定量解析であるトランスクリプトーム解析,網羅的タンパク質発現解析であるプロテオーム解析,網羅的低分子量化合物解析であるメタボローム解析という,生命活動の異なる階層の網羅的解析データの多重相関解析から生命現象を解き明かそうとする「統合オミクス」解析(図4)が宿主-腸内細菌叢相互作用の研究に応用されている。
臨床活用に向けて
ヒト疾患のメタゲノム解析と動物実験による検証により,腸内細菌叢が様々な疾患の病態の形成に関係するということや,疾患によっては逆に発症や病態を抑制する腸内細菌の存在も,ここ十年余りの間に明らかとなってきた。それらの腸内細菌叢の特性を利用した臨床活用に向けた取り組みとしては,疾患に特徴的な腸内細菌の検出を,疾患のスクリーニングや予後,あるいは発症予測のバイオマーカーとして利用することが考えられる2)。治療への活用では,特にがん領域において,インターフェロンγ産生性CD8+T細胞を誘導する腸内細菌と,チェックポイント阻害剤との併用による抗癌作用増強が着目されている3)。
また,食物由来のホスファチジルコリンやL-カルニチンから腸内細菌が産生するトリメチルアミンが門脈から吸収されて肝臓の酵素によりさらに変換されてできるトリメチルアミン-N- オキシドが,動脈硬化を悪化させることが示された。このトリメチルアミン産生に関わる腸内細菌の酵素の阻害薬が開発され,マウスにおいては動脈硬化の抑制効果が認められており4)-6),臨床への応用が期待される。
このような中で,腸内細菌叢の臨床活用が実用化された最たる例は,代表的な菌交代症であるClostridioides difficile(以前はClostridium difficile)感染症に対する糞便微生物移植である7)。糞便微生物移植は難治性のC. difficile感染症に奏効するため,現在では米国をはじめとするC. difficile感染症の罹患率,死亡率の高い国では,難治性の治療指針の第一選択とされている。さらに炎症性腸疾患などをはじめとする様々な疾患で有効性が注目され,臨床試験がなされている8)。
◆
上述のように腸内細菌叢のディスバイオーシスは様々な疾患で報告されているが(図2),本連載では,腸内細菌叢と疾患との関連について精力的に取り組んでおられる先生方に,それぞれの疾患についての解説をお願いしている。具体的には,「関節リウマチ」(大阪大学・竹田潔先生,前田悠一先生),「2型糖尿病」(関西医科大学・入江潤一郎先生),多発性硬化症(国立精神・神経医療研究センター・竹脇大貴先生),「うつ病・自閉症」(帝京大学・功刀浩先生),炎症性腸疾患(慶應義塾大学・金井隆典先生)について連載する予定である。
【文献】
1)Sender R, et al: Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 2016;14(8): e1002533.
2)Wong SH, et al:Gut microbiota in colorectal cancer: mechanisms of action and clinical applications. Nat Rev Gastroenterol Hepatol. 2019;16(11):690-704.
3)Zhao LY, et al:Role of the gut microbiota in anticancer therapy: from molecular mechanisms to clinical applications. Signal Transduct Target Ther. 2023;8(1):201.
4)Wang Z, et al:Non-lethal inhibition of gut microbial trimethylamine production for the treatment of atherosclerosis. Cell. 2015;163(7):1585-95
5)Li X, et al:Berberine attenuates choline-induced atherosclerosis by inhibiting trimethylamine and trimethylamine-N-oxide production via manipulating the gut microbiome. NPJ Biofilms Microbiomes. 2021;7(1):36.
6)Chen ML, et al:Resveratrol attenuates trimethylamine-N-oxide (TMAO)-induced atherosclerosis by regulating TMAO synthesis and bile acid metabolism via remodeling of the gut microbiota. mBio. 2016;7(2):e02210-15.
7)van Nood E, et al:Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med. 2013;368(5):407-15.
8)Wang JW, et al:Fecal microbiota transplantation: Review and update. J Formos Med Assoc. 2019;118(Suppl 1):S23-S31.




































