お知らせ
2型糖尿病への臨床活用:腸内細菌による代謝物が病態に及ぼす影響[最新論文で学ぶ 腸内細菌叢の臨床活用(3)]
今回注目する論文
Takeuchi T, et al:Gut microbial carbohydrate metabolism contributes to insulin resistance. Nature. 2023;621(7978):389-95.
インスリン抵抗性とインスリン分泌不全を背景に発症する2型糖尿病において,腸内細菌と宿主のメタボロミクス,メタゲノミクス,トランスクリプトームデータを包括的に組み合わせたマルチオミクス解析を行い,インスリン抵抗性に関わる腸内細菌と腸管内代謝の関係性について検討された。その結果,細菌による単糖合成がインスリン抵抗性に重要であることがわかり,またその合成に関わる細菌種が明らかになった。モデル動物へのこれらの細菌の投与により,腸管内の単糖が減少しインスリン感受性が改善したことから,ヒトのインスリン抵抗性における腸内細菌による腸管内炭水化物代謝も同様と考えられ,腸内細菌の重要性が明らかにされた。
Natividad JM, et al:Impaired Aryl Hydrocarbon Receptor Ligand Production by the Gut Microbiota Is a Key Factor in Metabolic Syndrome. Cell Metab. 2018;28(5):737-49.
腸内細菌によるトリプトファンの代謝産物は,腸管に発現する芳香族炭化水素受容体(AhR)のアゴニストとなるため,腸管免疫や腸管バリア機能の維持,腸管ホルモン分泌に重要であることが知られている。本研究では,2型糖尿病や肥満症,高血圧症を有する患者で,腸管内のAhRアゴニスト濃度が低いことが示された。肥満糖尿病モデルマウスにおいても,腸管内AhRアゴニスト濃度は低く,腸管IL-22などAhRの下流遺伝子の発現も低下していた。AhRアゴニストまたはAhRアゴニスト産生能の高い乳酸菌を投与すると,腸管バリア機能と腸管ホルモン分泌が維持され,耐糖能は改善した。これらの知見から,ヒト糖代謝異常症における腸内細菌によるアミノ酸代謝の重要性が示された。
近年,2型糖尿病において,腸内細菌叢の機能的変化が病態に大きく関与していることが示唆されている。腸内細菌が,糖やアミノ酸の代謝産物を介してインスリン感受性や腸管バリア機能に影響を与えることが報告されており,その具体的なメカニズムを探る研究が進展している。本稿では,腸内細菌による糖代謝とアミノ酸代謝に焦点を当てた研究を踏まえ,2型糖尿病の病態における腸内細菌による代謝物の関与について,最新の知見を整理する。
2型糖尿病と腸内細菌叢・腸管代謝産物
世界で急増する2型糖尿病や肥満症などのエネルギー糖代謝異常症に,腸内細菌が関連していることが2000年代に報告された。以降,腸内細菌が疾患の病態解明・治療標的として注目を集め,基礎・臨床研究が多く行われている1)。
疾患を有するマウスや患者では,腸内細菌叢において門レベルで対照と差が認められるとの報告が当初はなされた。その後,複数の大規模研究が実施され,それらのメタ解析では異なる民族で均一の変化は見出されていない2)が,機能的観点から腸内細菌を検討すると,腸管バリア維持に資すると考えられる短鎖脂肪酸産生菌やAkkermansia属の細菌が少ないことなどが観察されている。糖尿病が多くの民族で発症することをふまえると,様々な民族において腸内細菌が共通に有する機能に変化が生じていると推測される。
したがって,2型糖尿病において,腸内細菌の種の同定だけではなく,代謝酵素遺伝子発現や腸管内代謝産物量まで踏み込んだ研究が必要である。実際に,肥満者では腸内細菌叢全体で有している遺伝子が少ない(gene richnessの低下)ことが報告されており,細菌叢全体として機能に偏りが生じていると考えられる3)。
なお,代謝産物を含め腸内細菌叢と糖尿病については様々な報告がなされているが,糖尿病を有する個体では腸管を含めた組織中のグルコース濃度が高くなるため,実臨床の患者を対象とした検討では,高血糖の影響を排除することが容易ではない。さらに実際の患者では薬物治療を受けていることが多く,ジメチルビグアナイド(メトホルミン)のように抗菌作用を有する糖尿病治療薬が使用されている場合,その影響を除外する必要がある4)。
2型糖尿病と腸管内糖代謝
近年,日本人のインスリン抵抗性を有する患者における腸管内代謝について,新しい知見が見出された5)。306人の患者の腸内細菌および便中代謝産物を網羅的に検討し,統合オミクス解析が実施された。細菌叢とインスリン抵抗性の程度から患者は4群に大別され,Blautia属やDorea属の細菌を多く含む腸内細菌叢を有する集団では,インスリン感受性が低く,一方,Bacteroides属,Alistipes属,Faecalibacterium属を多く含む腸内細菌叢を有する対象ではインスリン感受性が高かった。腸管内の代謝産物については,便中のフルクトース,ガラクトース,マンノースなどの単糖類の濃度が患者のインスリン抵抗性と正相関していることが見出され,これは他のコホート研究でも確認された(表1)。
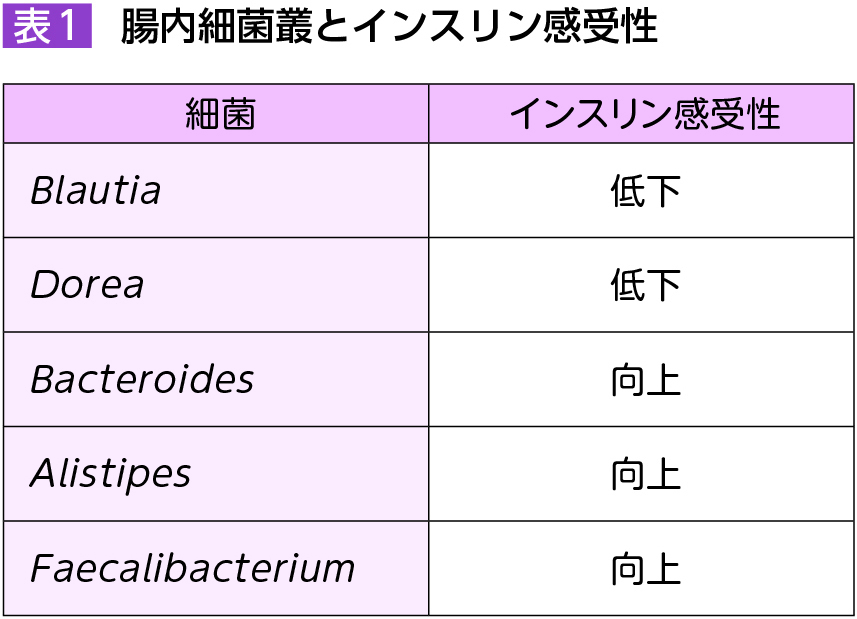
Lachnospiraceae科のDorea属は多糖類の分解に関与しているとされており,本知見と合致するものであった。また,Blautia属やDorea属の細菌を多く含む腸内細菌叢を有する対象では,二糖類の分解に寄与するアミロスクラーゼが多く認められた。一方,腸内細菌種のうちAlistipes属はインスリン感受性と相関を示し,単糖類の濃度と負の相関を示した。さらにこれらの単糖類は血清IL-10値とも関連しており,腸内細菌が産生する単糖類がサイトカイン産生を介して,宿主のインスリン抵抗性を規定していると考えられた。
さらにAlistipes属のひとつ,A. indistinctusを,高脂肪食を与えインスリン抵抗性を惹起したマウスに投与したところ,Bacteroides thetaiotaomicronなどの別菌種を投与されたマウスに比較して,インスリン感受性が良好であり,これはA. indistinctusによる肝臓や脂肪組織のインスリンシグナリングの改善のためと考えられた。A. indistinctusを投与されたマウスでは,腸管内のマンノースなどの単糖が減じており,腸管内の単糖量とインスリン抵抗性とに相関が認められた。
本研究では,患者の腸管内代謝産物のデータに基づいたインスリン抵抗性の予測能は,腸内細菌叢の16S遺伝子データに基づいた予測能を上回ることが示されており,今後は,腸内細菌が腸管内で産生する代謝産物に注目して糖尿病の病態を理解する重要性が明らかにされた。
2型糖尿病と腸管内アミノ酸代謝
腸管内でトリプトファンはインドール,インドール酢酸などに代謝され,腸管免疫や腸管上皮の恒常性維持において重要な役割を果たす芳香族炭化水素受容体(aryl hydrocarbon receptor:AhR)のアゴニストとして作用する。AhRを介した刺激は,腸管バリア機能や腸管免疫などの腸管恒常性維持に重要であり,また腸管内分泌細胞から腸管ホルモンであるGlucagon-like peptide 1(GLP-1)の分泌を促進する作用を有している。
この腸管内容物中のAhRアゴニスト濃度を約100名の患者で検討したところ,肥満症や2型糖尿病患者では対照者に比較して低いことが報告された6)。Body mass index(BMI)30kg/m2以上の患者では,BMI 30kg/m2未満の患者より腸管内容物AhRアゴニスト濃度が低く,AhRアゴニスト濃度はBMIと逆相関を示していた。また2型糖尿病を有する患者,高血圧症を有する患者でも,AhRアゴニスト濃度は有意に低値であった。高脂肪食を与え肥満糖尿病を誘導したモデル動物に対して,AhRアゴニストやAhRリガンド産生の高いLactobacillus reuteri菌(Limosilactobacillus reuteri菌)を経口投与すると,腸管バリア機能が回復し,耐糖能とインスリン抵抗性が改善した(図1)。
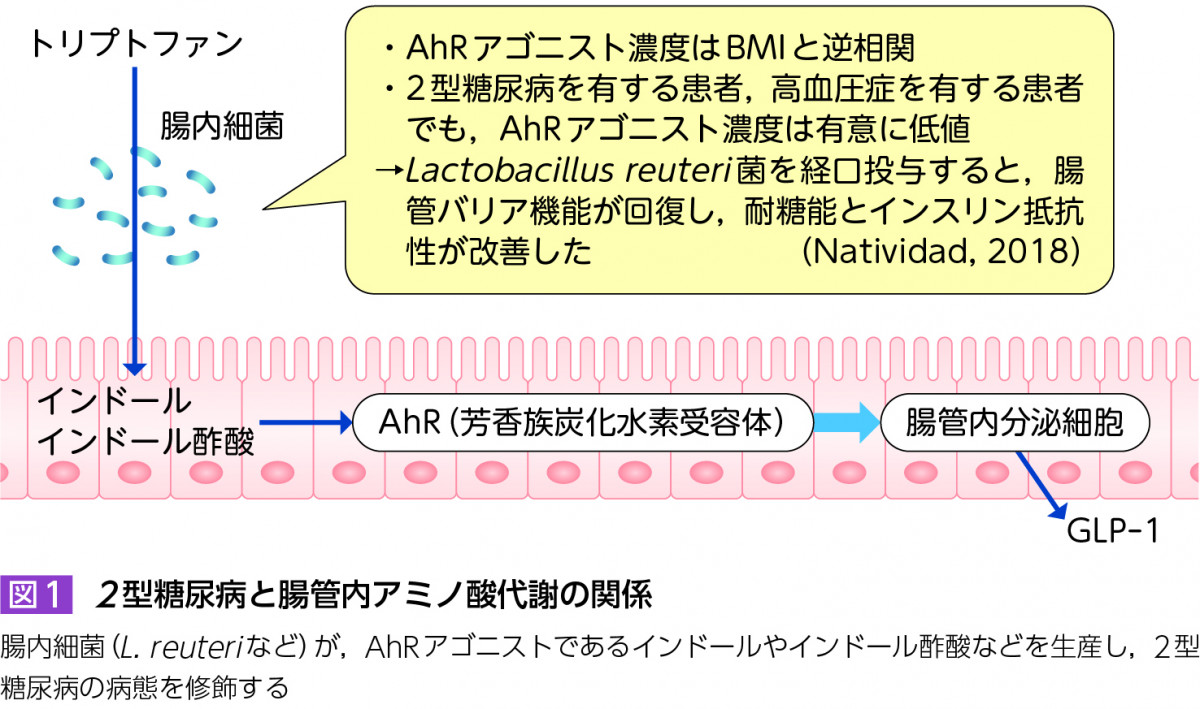
以上の知見から,腸内細菌がトリプトファンから分解産生するインドール類が,2型糖尿病・インスリン抵抗性の病態の改善に関与していると考えられた。
まとめ
2型糖尿病における腸内細菌の研究は,特定の腸内細菌種の探索から,腸内細菌が作り出す代謝産物の検討に照準が変化しつつあり,本稿で紹介した糖質,アミノ酸以外に,脂肪酸や胆汁酸の代謝産物に関しても2型糖尿病で異なることが報告されている。たとえば,リノール酸の代謝産物のひとつである10-ヒドロキシ-シス-12-オクタデセン酸は,マウスやヒトの糖代謝異常症を改善する可能性が指摘されている。今後,新たに見いだされた代謝産物を応用した2型糖尿病の治療開発が期待される。
【文献】
1)Ley RE, et al:Obesity alters gut microbial ecology. Proc Natl Acad Sci U S A. 2005;102(31):11070-5.
2)Michels N, et al:Human microbiome and metabolic health: An overview of systematic reviews. Obes Rev. 2022;23(4):e13409.
3)Le Chatelier E, et al:Richness of human gut microbiome correlates with metabolic markers. Nature. 2013;500(7464):541-6.
4)Forslund K, et al:Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota. Nature. 2015;528(7581):262-6.
5)Takeuchi T, et al:Gut microbial carbohydrate metabolism contributes to insulin resistance. Nature. 2023;621(7978):389-95.
6)Natividad JM, et al:Impaired Aryl Hydrocarbon Receptor Ligand Production by the Gut Microbiota Is a Key Factor in Metabolic Syndrome. Cell Metab. 2018;28(5):737-49.



































