お知らせ
うつ病や自閉スペクトラム症への臨床活用:プロバイオティクスや食物繊維の効果の可能性[最新論文で学ぶ 腸内細菌叢の臨床活用(6)]
今回注目する論文
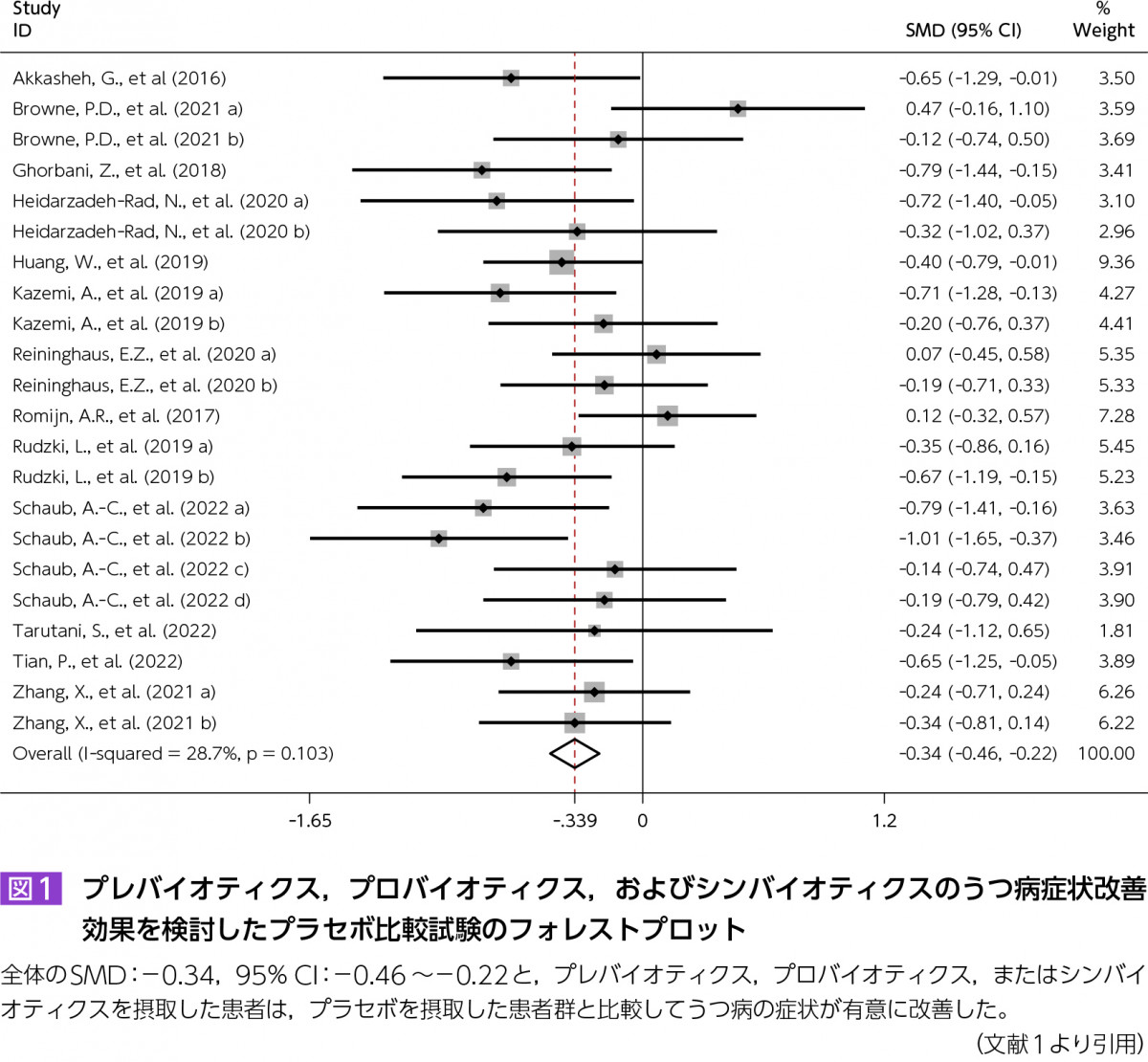
Zhang Q, et al:Effect of prebiotics, probiotics, synbiotics on depression: results from a meta-analysis. BMC Psychiatry. 2023;23(1):477.
近年,うつ病に対するプロバイオティクスやプレバイオティクス,両者を含むシンバイオティクスの効果を検討するランダム化比較試験(randomized controlled trial:RCT)も少なからず報告されている。Zhangらによる本論文では,そうした研究のメタアナリシスを行った(合計で786人の参加者を対象とした13件のRCT)。全体的な結果では,プレバイオティクス,プロバイオティクス,またはシンバイオティクスを摂取した患者は,プラセボを摂取した患者群と比較してうつ病の症状が有意に改善した。ただし,サブグループ解析では,プロバイオティクスを含む成分でのみ有意な抗うつ効果が認められた。また,軽度または中等度のうつ病の患者は,どちらも治療の恩恵を受ける可能性が示唆された。女性の割合が低い研究では,うつ病の症状を緩和する効果がより強かったという。
Kunugi H:Gut Microbiota and Pathophysiology of Depressive Disorder. Ann Nutr Metab. 2021;77 Suppl 2:11-20.
本論文では,腸内細菌叢とうつ病の病態について総説している。うつ病の病態生理には,少なくとも4つの生物学的メカニズムが関与する。すなわち,①モノアミン〔特にドパミン(ドーパミン)〕神経系,②視床下部-下垂体-副腎系および自律神経系によるストレス反応,③炎症,④脳由来神経栄養因子である。うつ病の動物モデルでの研究により,腸内細菌叢がこれらの機能と密接に関連していることが示唆されている。うつ病患者の腸内細菌叢プロファイルの研究も少なくなく,結果は一致していないものの,酪酸などの短鎖脂肪酸を生成する細菌や,代謝性疾患を予防する細菌(例:バクテロイデス)が少ないことが報告されている。プロバイオティクスの臨床試験ではZhangらの論文1)の通り,うつ病症状や関連する生物学的マーカーへの有益な効果が示唆されてきている。以上から,腸脳相関に関する研究が,うつ病の病態生理を解明し,新たな治療法を開発する上で有望である。
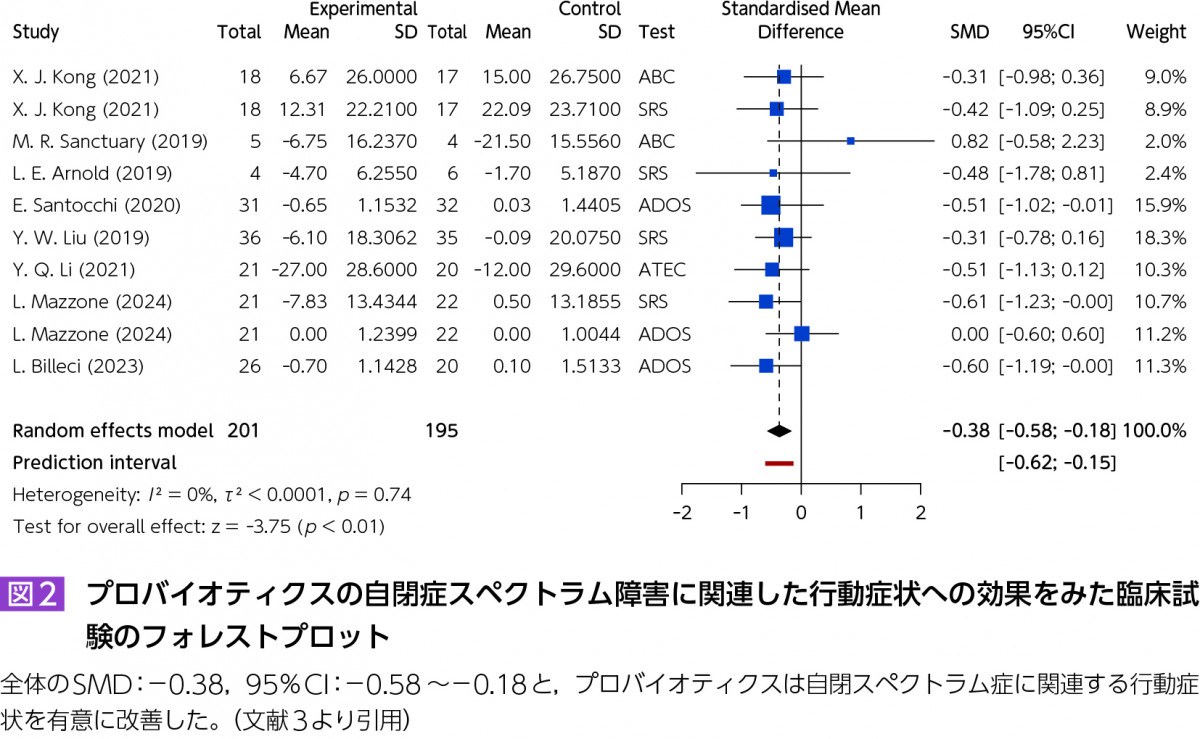
Soleimanpour S, et al:Probiotics for autism spectrum disorder: An updated systematic review and meta-analysis of effects on symptoms. J Psychiatr Res. 2024;179:92-104.
本論文では,2019~2024年に発表された比較的新しい8つの研究による自閉症スペクトラム障害(autism spectrum disorder:ASD)患者(1.5~20歳までの計318人)を対象としたプロバイオティクスの効果をみた臨床試験のメタアナリシスを行った(図2)。その結果,プロバイオティクス介入群は対照群と比較して行動症状を有意に改善することが示唆された。層別化解析では,欧州で実施された研究,3カ月以上継続した介入において,より顕著な効果がみられた。複数菌株のプロバイオティクスと単一菌株の介入では,前者の効果量が後者のそれより高かった。これらの結果は出版バイアスの可能性が低く,ASDへのプロバイオティクスについてさらに検討する価値があることが示唆された。
うつ病と腸内細菌叢
世界保健機構の調査によれば,うつ病の時点有病率は4.4%という数字があり,世界の人口のおよそ20~25人に1人がうつ病に罹患している。年間およそ80万人(日本では2024年に2万268人:警察庁発表)が自殺しているとされ,うつ病はその大きな要因となっている。また,うつ病は職場における長期休職などパフォーマンス低下の大きな要因にもなっている。
うつ病の薬物療法では,選択的セロトニン再取り込み阻害薬やセロトニン・ノルアドレナリン再取り込み阻害薬を第一選択とする薬物療法が行われるが,これらの1剤を十分使っても寛解率は1/3,2剤を十分使用しても寛解率はおよそ半数にとどまるとされ,新たな治療法の開発が喫緊の課題である。冒頭で紹介したZhangらの論文1)で示唆されるように,近年,腸内細菌叢との関連やプロバイオティクス・プレバイオティクスの効果も指摘されるようになり,腸内細菌に注目した研究は,今後,うつ病の治療や予防において重要な役割を果たすようになると考えられる。
うつ病患者と健常者の腸内細菌叢を比較した研究は,筆者が知る限り,2014年以降に発表され,腸内細菌叢のoperational taxonomic unit(OTU)解析による結果が報告されている。これまでに,いくつかの研究グループによって検討され,そのメタアナリシスもなされているが,うつ病で特異的に変化している菌として一致した結果は得られていない4)。しかし,短鎖脂肪酸である酢酸や酪酸を産生するLachnospiraceaeや酪酸を産生するFaecalibacteriumが,うつ病患者群の腸内細菌叢で低下している結果を得た研究が複数あり,筆者らの検討(後述)では,乳酸(代謝されて短鎖脂肪酸が生成されうる)や酢酸(短鎖脂肪酸の1つ)を産生するBifidobacteriumの菌数が有意に少なかった。また,うつ病患者群におけるBacteroidetes(現在の分類ではBacteroidota)の低下もいくつかの研究で報告されているが,Bacteroidetesの低下は肥満や糖尿病との関連が示唆されている。うつ病とこれらの代謝性疾患との間には双方向性の関連があることが知られている。
Bifidobacteriumの役割:筆者らの検討から
筆者らは,大うつ病性障害患者と健常者を対象に,いわゆる有用菌/善玉菌と言われる腸内細菌について定量PCR法を用いた解析を行ったところ,Bifidobacterium属は患者群で有意に少なく,Lactobacillus属も少ない傾向であったことを報告した5)。双極性障害患者の腸内細菌での解析では同様の結果は観察されなかったが,Bifidobacteriumの数と血中コルチゾール値との間に負の相関がみられ,Bifidobacteriumが多い人は視床下部-下垂体-副腎系のストレス応答が穏やかである可能性が示唆された6)。さらに,うつ病患者にLacticaseibacillus caseiのShirota株を投与して経過をみたところ,症状改善度が高かった群は低かった群と比較して投与開始時のBifidobacteriumの数が明らかに多いことを観察した7)。以上から,Bifidobacteriumはストレス応答の緩和などを通じてうつ病症状に効果があると考えられる。
うつ病患者に対するプロバイオティクスやプレバイオティクスの効果
うつ病患者に対して,プロバイオティクスやプレバイオティクスを投与することで,臨床症状を軽減することができるかを検討する臨床研究が報告されるようになった。そうした試みは,筆者が知る限り,2016年に発表されたAkkashehら8)によるものが最初である。彼らは,大うつ病患者に対してプロバイオティクス〔Lactobacillus acidophilus,Lactobacillus casei(現在の分類ではLacticaseibacillus casei),Bifidobacterium bifidum〕かプラセボを投与したところ(抗うつ薬投与者への上乗せではない),うつ病症状のみならず,耐糖能,炎症,抗酸化作用の指標に対しても,有意な改善効果を持っていると報告した。その後,抗うつ薬の増強効果をみるものを含めて多くの検討がなされ,プロバイオティクスのみならず,プレバイオティクス,両者を合わせたシンバイオティクスの効果に関する検討が行われている。そのメタアナリシスがZhangらの論文1)である。この論文の層別化解析ではプレバイオティクスのみでは効果が明確でないとされるが,食物繊維の摂取量が多いとうつ病のリスクが低下するというメタアナリシスの結果が報告されており9),プレバイオティクスの効果も期待できると考えられる。
妊産婦はうつ病を発症しても,催奇形性や乳汁への混入のリスクから,抗うつ薬投与に関する安全性が必ずしも確立されていない。そこで,プロバイオティクスの効果が期待され,臨床研究が少なくない。過去16研究(946人の妊婦と524人の授乳中の母親,1678人の新生児)のメタアナリシスによれば,プロバイオティクス(Bifidobacterium,Lactobacillus,またはその両者)は母親の不安や抑うつを軽減し,新生児の啼泣や腹部症状の軽減効果もみられた10)。
有効性のメカニズム
冒頭のKunugiの論文2)で紹介したように,うつ病はストレス応答(視床下部-下垂体-副腎系,自律神経系),モノアミン(特にドパミン系),炎症,神経可塑性分子(脳由来神経栄養因子など)が関与する。典型的なうつ病では,ストレスにより視床下部-下垂体-副腎系の活動が亢進し,ストレスホルモン(グルココルチコイド:ヒトではコルチゾール)が過剰に放出される。これは神経保護効果のある脳由来神経栄養因子などの発現や機能の低下をきたし,海馬や前頭葉を傷害すると考えられる。海馬はストレス応答を制御しており,前頭葉の機能低下は不安や抑うつを惹起する。また,ドパミン神経系も障害され,それが快感喪失や興味・喜びの低下につながる。肥満や糖尿病などにより身体が軽度の慢性炎症をきたしていると,神経炎症に波及するとともに,トリプトファン-キヌレニン経路を活性化し,キノリン酸による興奮毒性を生じて脳を傷害するほか,気分の安定に関与するセロトニンの低下につながる。
以上のような概要でうつ病が発症すると考えられるが,腸内細菌は上記の病態に密接に関与する。腸内細菌が視床下部-下垂体-副腎系の発達に重要な影響を与えることや,有用菌が前頭葉や海馬の脳由来神経栄養因子の発現を高めることは,動物実験などによって示されてきた。さらに,腸内細菌が産生する酪酸などの短鎖脂肪酸は,消化管内の迷走神経を刺激してストレス応答を緩和するとともに,炎症に対しても抑制的に作用することが示唆されている。動物実験による結果から,さまざまな腸内細菌がドパミンなどのモノアミン・シグナルに影響を与えることが示唆されている。
以上のように,プロバイオティクスは,種々のメカニズムにおいてうつ病に対するレジリエンスを高める効果があると考えられる。プレバイオティクスは腸内細菌を豊かにし,プロバイオティクスと同様にうつ病を緩和することが考えられる。
自閉症スペクトラム障害と腸内細菌叢
ASDは通常3歳までに徴候が現われ,社会性の獲得,限定的な行動パターンなどの行動学的問題を呈する。他人と関わることへの興味が弱いことや,非言語的コミュニケーションが上手くできず,言語発達の遅れがみられることもある。また,特定の事柄や対象物に対するこだわりが強く,日常の過ごし方でのこだわりも強い。新規の物事に対して混乱し,癇癪を起こすなどの不適応症状を現すことも多い。聴覚,触覚,味覚,嗅覚,視覚などに対する過敏があることが多く,嗅覚や味覚への過敏性やこだわりにより特定の食物以外は受け付けなくなり(偏食),極端になると「回避・制限性食物摂取症」を発症し,神経性食思不振症と同様の重度のやせや栄養不良をきたすこともある。ASDの病因は不明であるが,遺伝的要因,毒素への暴露,免疫学的異常のほか腸内細菌叢の異常などが関与すると考えられている。
治療は知的障害を伴う場合は,療養施設などで対応を図り,そうでない場合は,デイケアなどの場を用いて対人場面の対処法について,体験を通じたトレーニングを行う。薬物療法は一部の抗精神病薬において易刺激性などの症状に対する適応があるが,根本的治療にはならず,対症療法として用いられる。したがって,新たな治療法の開発が喫緊の課題となっており,プロバイオティクスはその候補の1つとなる。
ASDに対する腸内細菌叢の検討は,比較的早期からなされており,2002年にFinegoldら11)が,ASD児では健常児と比較してClostridium属の菌数が多く,菌種も多いという結果を報告した。その後ASD児では,神経毒を産生するClostridium histolyticum(現在の分類ではHathewaya histolytica)が増えていたという結果も続いて報告された12)。また,Sutterella(胆汁酸に耐性であり,腸内環境に影響を与える可能性が指摘されている)が増加していたという報告も複数ある。しかし,その後の検討により,ASD児の特徴的な腸内細菌叢の異常としてはっきりしたものはいまだに確立していない。なお,腸の透過性亢進(いわゆるleaky gut)に関する検討もあり,コントロール児における頻度が4.8 %であったのに対し,ASD児では,36.7 %と頻度が高かったという報告がある13)。腸上皮のバリア機能の破綻は炎症や毒素の体内侵入の要因となる。
以上のように腸内環境の悪化(偏食が寄与すると考えられる)やバリア機能の破綻(およびそれによる毒素の侵入)などがASDの病態に関与し,さらにコミュニケーション障害や行動異常が周囲との軋轢を生み,本人にとってのストレスを生じてさらなる症状が誘起されるとすれば,腸内環境を改善するプロバイオティクスやプレバイオティクスの有用性が期待される。プロバイオティクスの最近の検討では,冒頭で紹介したSoleimanpourらの論文3)にあるように,メタアナリシスによって効果があることが示唆されている。プレバイオティクスやシンバイオティクスについても他のメタアナリシスによって効果が示唆されている14)。
まとめ
うつ病・ASDにおける腸内細菌叢に関する検討,プロバイオティクス,プレバイオティクスの臨床試験について概観した。これらの疾患に特異的な腸内細菌の異常(dysbiosis)は一致した結果が得られていないが,腸内環境の改善が疾患の治療や予防に有効である可能性を示唆する多面的なエビデンスが蓄積され,臨床試験の蓄積によりプロバイオティクス,プレバイオティクスの有効性が実証されてきている。今後,さらに検討を重ね,どのような菌(あるいはその組み合わせ)がより有効であるかなどについて明らかにし,臨床応用につながることが期待される。
【文献】
1)Zhang Q, et al:Effect of prebiotics, probiotics, synbiotics on depression: results from a meta-analysis. BMC Psychiatry. 2023;23(1):477.
2)Kunugi H:Gut microbiota and pathophysiology of depressive disorder. Ann Nutr Metab. 2021;77(Suppl 2):11-20.
3)Soleimanpour S, et al:Probiotics for autism spectrum disorder: An updated systematic review and meta-analysis of effects on symptoms. J Psychiatr Res. 2024;179:92-104.
4)Barandouzi ZA, et al:Altered composition of gut microbiota in depression: a systematic review. Front Psychiatry. 2020;11:541.
5)Aizawa E, et al:Possible association of Bifidobacterium and Lactobacillus in the gut microbiota of patients with major depressive disorder. J Affect Disord. 2016;202:254-7.
6)Aizawa E et al: Bifidobacterium and Lactobacillus counts in the gut microbiota of patients with bipolar disorder and healthy controls. Front Psychiatry. 2019;9:730.
7)Otaka M, et al:Effect of Lacticaseibacillus paracasei strain Shirota on improvement in depressive symptoms, and Its association with abundance of actinobacteria in gut microbiota. Microorganisms. 2021;9(5):1026.
8)Akkasheh G, et al:Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition. 2016;32(3):315-20.
9)Fatahi S, et al:Association of dietary fiber and depression symptom: A systematic review and meta-analysis of observational studies. Complement Ther Med. 2021;56:102621.
10)Halemani K, et al:Impact of probiotic on anxiety and depression symptoms in pregnant and lactating women and microbiota of infants: A systematic review and meta-analysis. J Glob Health. 2023;13:04038.
11)Finegold SM, et al:Gastrointestinal microflora studies in late-onset autism. Clin Infect Dis. 2002;35(Suppl 1):S6-S16.
12)Parracho HM, et al:Differences between the gut microflora of children with autistic spectrum disorders and that of healthy children. J Med Microbiol. 2005;54(Pt 10);987-91.
13)de Magistris L, et al:Alterations of the intestinal barrier in patients with autism spectrum disorders and in their first-degree relatives. J Pediatr Gastroenterol Nutr. 2010;51(4):418-24.
14)Tan Q, et al:Probiotics, prebiotics, synbiotics, and fecal microbiota transplantation in the treatment of behavioral symptoms of autism spectrum disorder: A systematic review. Autism Res. 2021;14(9):1820-36.



































