お知らせ
関節リウマチへの臨床活用:Prevotella属細菌の動態と関節リウマチの病態の関与[最新論文で学ぶ 腸内細菌叢の臨床活用(2)]
今回注目する論文
Maeda Y, et al:Dysbiosis Contributes to Arthritis Development via Activation of Autoreactive T Cells in the Intestine. Arthritis Rheumatol. 2016;68(11):2646-61.
Nii T, et al:Genomic repertoires linked with pathogenic potency of arthritogenic Prevotella copri isolated from the gut of patients with rheumatoid arthritis. Ann Rheum Dis. 2023;82(5):621-9.
Nayak RR, et al:Methotrexate impacts conserved pathways in diverse human gut bacteria leading to decreased host immune activation. Cell Host Microbe. 2021;29(3):362-77.
関節リウマチ(RA)の発症初期に腸内でPrevotella属細菌の増多がみられることが報告されている。筆者らは,RA患者の腸から単離されたP. copri菌がトランスポゾンと呼ばれる菌株間を水平伝播する特有の遺伝子領域を持ち,この株がマウスの関節炎感受性の悪化に関与することを明らかにした。一方で,腸内でのPrevotella属細菌の増多が,RA治療反応性にどのような影響を与えるかは明らかではない。
本稿では,筆者らの研究結果に加え,腸内Prevotella属細菌の増多と治療反応性の関連,および免疫疾患における糞便移植療法,食事療法について概説する。
Prevotella属細菌の異常と関節リウマチ
関節リウマチ(rheumatoid arthritis:RA)は,人口の約0.5~1%に発症する,関節の骨破壊や肺病変,腎病変などをきたす代表的な自己免疫疾患である。環境要因については,喫煙,歯周病や腸内細菌が注目されているが,筆者らは腸内細菌叢の変化に着目して研究を行った。発症初期のRA患者の腸内細菌叢の組成が健常者と異なることが報告されている(表1)。
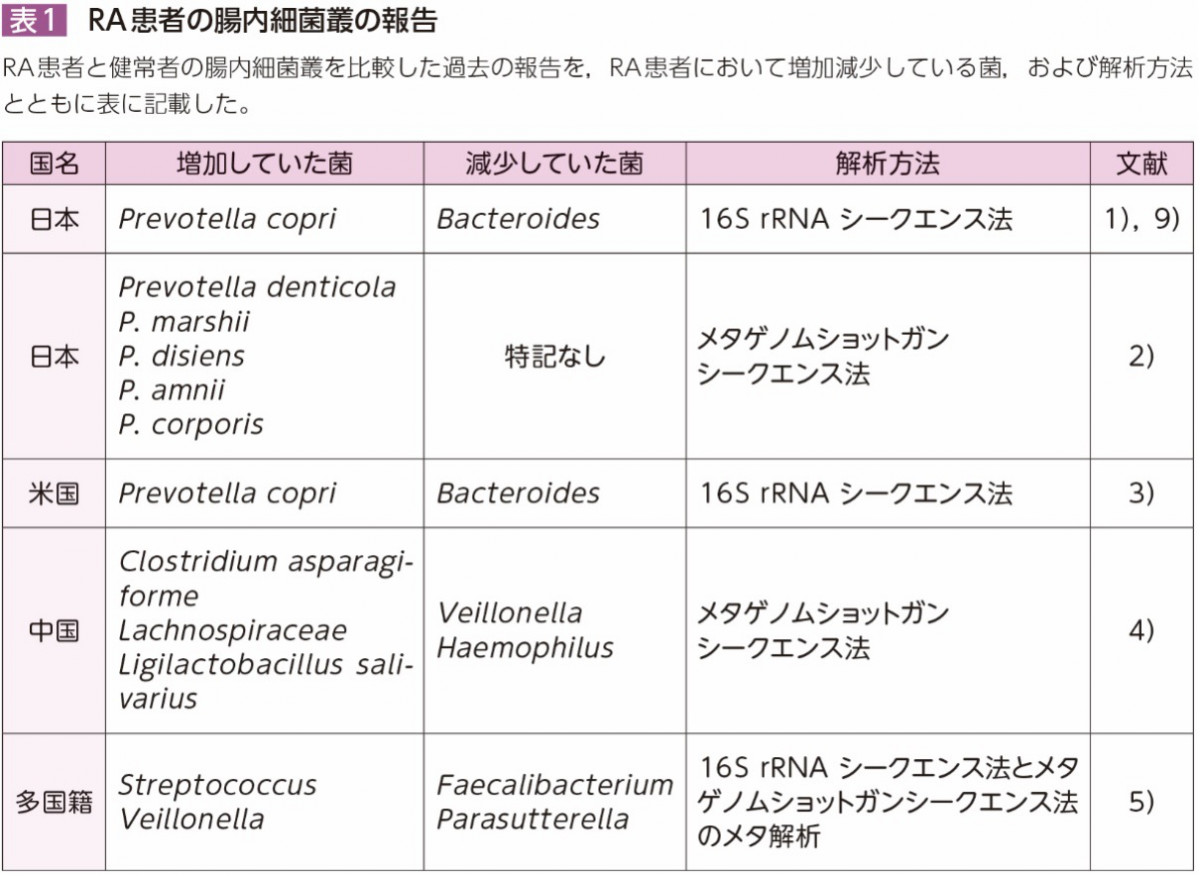
筆者らは,発症早期の日本人のRA患者と健常者の腸内細菌叢を16S rRNAを標的としたシークエンス法を用いて解析した。約30%のRA患者において偏性嫌気性菌であるPrevotella属細菌の増加が認められ,P. copriが優勢であった1)。さらに,被験者数を増やしたメタゲノムショットガンシークエンス法では,RA患者においてP. denticola,P. marshiiなどのPrevotella属細菌が健常者に比べて有意に増加していることが示された2)。米国からも同様の結果が報告されている3)。同じRA患者でも,中国からの報告や多施設のメタアナリシスでは,異なる菌種の異常も報告されており,遺伝的背景や食事内容により違いがみられると考えられる4)5)。
RA患者由来のP. copriに存在する関節炎に関連する特有の遺伝子
Prevotella属細菌は,関節炎との関わりが示唆される一方,東南アジアやアフリカの健常者の腸内細菌叢で主要な存在とされ,食事中の穀物や食物繊維摂取の増加と関連していると考えられている。近年の研究により,P. copriは単一の細菌種ではなく,4つの異なるタイプ(clades)に分けられることが示唆され,"P. copri complex”として扱うべきであるとされている6)。Prevotella属細菌はその複雑さから,Segatella,Hoylesella ,Leyella ,Palleniellaという4つの属に分類され,Prevotella copriをSegatella copriと呼ぶ改訂が提案された7)。また,Segatella RNA colonization factorと名付けた低分子RNAが,S. copriの腸内への定着に必須であることが最新の研究により示された8)。
これらP. copriの多様性により,筆者らは健常者とRA患者におけるP. copriは性質が異なるのではないかと考えた。RA患者は関節炎を引き起こすような,いわゆる悪玉のP. copriが腸内で増殖しているのではないか。この仮説を検証するため,RA患者および健常者からP. copriをそれぞれ単離し,全ゲノム解析を行った9)。RA患者由来のP. copri(以下RA-P. copri)には,健常者由来のP. copri(以下HC-P. copri)にはない約100kbの特有の遺伝子が存在することが明らかとなった(図1)。
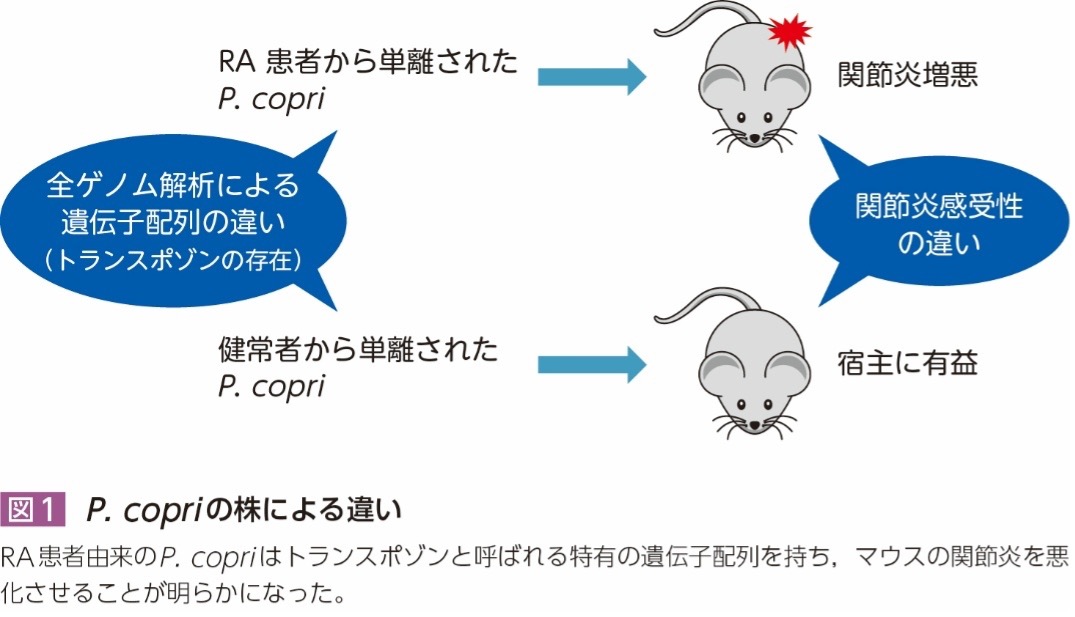
この領域はコンジュゲーティブトランスポゾン(conjugative transposon)と呼ばれる細菌間を伝播する遺伝子であることが確認された。この特有の遺伝子群が水平伝播したことにより,RA-P. copriは病原性を獲得した可能性が示唆された。また,RA-P. copriは樹状細胞の活性化を介してTh17細胞依存性の重篤な関節炎をマウスに引き起こすことを確認した。RA-P. copriに特有のトランスポゾンが関節炎の発症に関与している可能性があることから,今後の研究においてP. copriのどの遺伝子が病態に関与するか水平伝播の詳細を解明することが重要である。また,P. copriのどの成分が自然免疫の活性化やTh17細胞の増加に関与するのかを解析することで,より効果的な治療法の開発につながる可能性がある。
Prevotella属細菌の増多とメトトレキサート治療反応性の関連
Prevotella属細菌の増加がRAの治療反応性にどのような影響を与えるかは,明らかではない。メトトレキサート(Methotrexate:MTX)の治療反応性と腸内細菌叢の関連について解析したいくつかの報告が存在する。MTXは,RAの治療において中心的な役割を果たす抗リウマチ薬として広く使用されている。しかし,中等度から重度のRA患者の半数以上がMTX単独療法では寛解に至らず,本剤の治療反応性には個人差が大きいことが知られている。
ヒト糞便を移植したマウスを用いた研究では,MTXがジヒドロ葉酸還元酵素(dihydrofolate reductase)を阻害することにより,Prevotella属細菌を含むBacteroidetes門などの細菌の増殖を抑制し,その結果,腸内細菌のプリン・ピリミジン代謝やアミノ酸合成に関する代謝を変化させることを示された10)。この報告において,MTXはin vitroの実験で,直接Prevotella属細菌を含む菌の増殖を抑えた。また,MTX治療に良好に反応するRA患者では,治療前の時点で,菌の多様性が低い,Prevotella属細菌やBacteroides属細菌の比率が増加しているなどの特徴を有することが示された11)。
これらの研究結果は,MTXの治療反応性が特定の腸内細菌叢の変化と関連していることを示唆しており,Prevotella属細菌が腸内で多いほうがMTXの治療反応性が良いことを示唆する結果となった。RAの治療において,患者の腸内マイクロバイオームの情報をもとに治療の反応性を予測することが可能となれば,特定の患者に対する精密医療(precision medicine)の応用が期待される。
リウマチ性疾患における糞便移植療法
関節リウマチを対象とした試験ではないが,欧州で,MTXの治療下でも炎症の残存する関節症性乾癬患者に対して,糞便移植療法(fecal microbiota transplantation:FMT)が行われた。FMTもしくはプラセボに1対1で無作為に割り付け比較を行った。本試験では,重篤な有害事象は両群でなかったが,コントロール群に比べて糞便移植による病勢の改善は認められなかった12)。単一のコホートの研究であるため,さらなる集団での解析が必要であると考えられる。また,全身性強皮症患者5名に対して,4名のプラセボ群と比較し行われたFMTでは,下痢,腹部膨満感,便失禁などの症状の明らかな改善を認めたが,少人数での解析であるため,被験者数を増やした検討が必要である13)。
関節リウマチにおける食事療法
食事は腸内細菌叢や粘膜免疫系に影響を与え,食事介入が自己免疫疾患の改善に寄与する可能性が示されている14)。RA患者では便中の酪酸濃度が低下し,マウスモデルで酪酸投与が関節炎を軽減することが確認されている15)16)。酪酸などの短鎖脂肪酸は制御性T細胞の誘導や破骨細胞の分化抑制に関与する17)。また,腸内細菌叢が産生する短鎖脂肪酸に加え,食事由来の脂質成分もRAの炎症制御に影響を及ぼす。たとえば,ω3系多価不飽和脂肪酸(EPAやDHA)は抗炎症作用,心血管保護作用,脳神経保護作用など,古くより着目されてきた成分であり,in vitroの実験系にて,炎症性サイトカイン(TNF-α,IL-1β,IL-6)の産生抑制,T細胞の増殖抑制効果が示されている18)。
RAの疾患活動性のある患者では,ω3系多価不飽和脂肪酸の摂取により,血中IL-1β濃度の低下が確認されている19)。RAの疾患活動性改善を目的とした食事療法に関するシステマティックレビューでは,地中海食や魚油(ω3系多価不飽和脂肪酸)が疾患活動性指標を改善し,抗リウマチ薬との併用が推奨されている20)。しかし,欧米や日本のガイドラインには具体的な食事療法の記載がなく,質の高い比較対照試験の不足が課題である。既存の治療に,食事療法を組み合わせた新たな治療モデルや個別化医療の実現が期待される。
まとめ
本稿では,RA患者における腸内細菌叢の異常,特にP. copriの増多やRA患者に特有のP. copriの遺伝子が関節炎悪化に関与するメカニズムにつき記載した。また,Prevotella属細菌が腸内で多いほうがMTXの治療反応性が良好である,という複数の結果から,RAの治療薬が腸内細菌を是正することにより病態を改善させている可能性が示唆された。糞便移植療法や食事療法についてはエビデンスが十分ではなく,介入前後の腸内細菌叢を把握した上での詳細な検討が必要と考えられる。
【文献】
1) Maeda Y, et al:Dysbiosis Contributes to Arthritis Development via Activation of Autoreactive T Cells in the Intestine. Arthritis Rheumatol. 2016;68(11):2646-61.
2) Kishikawa T, et al:Metagenome-wide association study of gut microbiome revealed novel aetiology of rheumatoid arthritis in the Japanese population. Ann Rheum Dis. 2020;79(1):103-11.
3) Scher JU, et al:Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis. Elife. 2013;2:e01202.
4) Zhang X, et al:The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment. Nat Med. 2015;21(8):895-905.
5) Wang Y, et al:Gut dysbiosis in rheumatic diseases: A systematic review and meta-analysis of 92 observational studies. EBioMedicine. 2022;80:104055.
6) Tett A, et al:The Prevotella copri Complex Comprises Four Distinct Clades Underrepresented in Westernized Populations. Cell Host Microbe. 2019;26(5):666-79.e7.
7) Hitch TCA, et al:A taxonomic note on the genus Prevotella: Description of four novel genera and emended description of the genera Hallella and Xylanibacter. Syst Appl Microbiol. 2022;45(6):126354.
8) El Mouali Y, et al:The RNA landscape of the human commensal Segatella copri reveals a small RNA essential for gut colonization. Cell Host Microbe. 2024;32(11):1910-26.e6.
9) Nii T, et al:Genomic repertoires linked with pathogenic potency of arthritogenic Prevotella copri isolated from the gut of patients with rheumatoid arthritis. Ann Rheum Dis. 2023;82(5):621-9.
10) Nayak RR, et al:Methotrexate impacts conserved pathways in diverse human gut bacteria leading to decreased host immune activation. Cell Host Microbe. 2021;29(3):362-77.
11) Artacho A, et al:The Pretreatment Gut Microbiome Is Associated With Lack of Response to Methotrexate in New-Onset Rheumatoid Arthritis. Arthritis Rheumatol. 2021;73(6):931-42.
12) Kragsnaes MS, et al:Safety and efficacy of faecal microbiota transplantation for active peripheral psoriatic arthritis: an exploratory randomised placebo-controlled trial. Ann Rheum Dis. 2021;80(9):1158-67.
13) Fretheim H, et al:Fecal microbiota transplantation in systemic sclerosis:Adouble-blind,placebo-controlled randomized pilot trial. PLoS One. 2020;15(5):e0232739.
14) Wolter M, et al:Leveraging diet to engineer the gut microbiome. Nat Rev Gastroenterol Hepatol. 2021;18(12):885-902.
15) Takahashi D, et al:Microbiota-derived butyrate limits the autoimmune response by promoting the differentiation of follicular regulatory T cells. EBioMedicine. 2020;58:102913.
16) Rosser EC, et al:Microbiota-Derived Metabolites Suppress Arthritis by Amplifying Aryl-Hydrocarbon Receptor Activation in Regulatory B Cells. Cell Metab. 2020;31(4):837-51.e10.
17) Lucas S, et al:Short-chain fatty acids regulate systemic bone mass and protect from pathological bone loss. Nat Commun. 2018;9(1):55.
18) Dahan S, et al:Dietary factors in rheumatic autoimmune diseases: a recipe for therapy?. Nat Rev Rheumatol. 2017;13(6):348-58.
19) Espersen GT, et al:Decreased interleukin-1 beta levels in plasma from rheumatoid arthritis patients after dietary supplementation with n-3 polyunsaturated fatty acids. Clin Rheumatol. 1992;11(3):393-5.
20) Philippou E, et al:Rheumatoid arthritis and dietary interventions: systematic review of clinical trials. Nutr Rev. 2021;79(4):410-28.




































