お知らせ
塩野義製薬のCOVID-19ワクチン・治療薬開発:新製剤に変更しワクチン開発加速、年度内提供目指す─経口抗ウイルス薬の国内治験も開始【Breakthrough 医薬品研究開発の舞台裏】
新型コロナウイルス感染症(COVID-19)に対する国産ワクチンの早期実用化を目指す塩野義製薬。2020年4月に遺伝子組換えタンパクワクチンの開発を決定、同年12月に国内治験実施にこぎ着けたが、試験を進める中で「より高い中和抗体価を達成するにはアジュバントの切り替えが必要」と判断。アジュバントを変更した新製剤による国内第1/2相臨床試験を今年7月からあらためて開始した。塩野義は一方で、COVID-19をターゲットとした経口抗ウイルス薬の国内第1相臨床試験も7月から始めており、治療薬開発の行方にも注目が集まっている。
塩野義は当初、2021年秋頃の上市を目指して遺伝子組換えタンパクワクチンの開発を進めていた。しかし、2020年12月から始めた臨床試験では、高い安全性と細胞性免疫の一定の誘導が確認できたものの、ファイザーやモデルナのmRNAワクチンで確認されているような高い中和抗体価は達成できなかった。

アジュバント変更で高い中和抗体価確認
そこで、種々のアジュバントの組み合わせで再検討したところ、サルを用いた免疫原性試験で、アジュバントを変更した新製剤の2回接種により回復患者血清と同程度以上の高い中和抗体価が得られることを確認した。塩野義はこれを受け、開発方針を見直し、アジュバントを変更した新製剤であらためて国内治験を実施する計画を立て、今年7月から第1/2相臨床試験をスタートさせた。
ヒトと相関性の高いサルを用いた試験で良好なデータが確認されたことから、塩野義は「新製剤では、ヒトにおいてVDE(ワクチン関連疾患増悪)/ADE(抗体依存性感染増強)リスク回避と高い中和抗体価誘導の両立が期待できる」とし、新製剤で開発を加速させる考えを示している。
第1/2相試験では抗原量の低減化も検討。第3相試験は年内に開始し、3000例規模のデータで安全性・有効性を評価する方針だ。一方で、実際の感染予防・発症予防効果を確認するため、アジア・アフリカでプラセボ対照試験の準備も進めており、これらの試験のうち最速の試験結果をもとに規制当局・省庁と協議し2021年度内の国内提供を実現したいとしている。

接種後の副反応は「極めてマイルド」
塩野義の澤田拓子ヘルスケア戦略本部長は8月2日に開いた2021年度第1四半期決算説明会で、開発中の新製剤のワクチンについて「アルファ、ベータ、ガンマ、デルタと調べているが、デルタ株に対する中和活性の低下はほとんど見られていない。中和抗体価という観点で見る限り、デルタ株だからといって特に大きな影響はないと考えている」と説明。
接種後の副反応については「極めてマイルド。軽度の有害事象が数例に見られているというレベルで、従来の他の疾患に対するワクチンと近いプロファイルというイメージ」と述べた。
最終段階の大規模試験でもこうした有効性・安全性が確認されるかが今後の最大の焦点になる。
経口抗ウイルス薬の開発にも注力
塩野義は、COVID-19に対する取り組みの中でワクチンとともに治療薬の開発も最優先のプロジェクトに据えている。
COVID-19治療薬(開発コード:S-217622)の国内第1相臨床試験開始を発表した7月26日のプレスリリースでは「パンデミック終息に向けては、ワクチンだけでなく、体内のウイルス量を低下させ、重症化の抑制や臨床症状の改善が期待される抗ウイルス薬が求められている。特にCOVID-19は感染初期に無症候や軽症であっても急速に症状が進行することが報告されているため、安全かつ簡便に使用できる治療薬が必要とされている」として、特に低分子の経口抗ウイルス薬が求められていることを強調した。
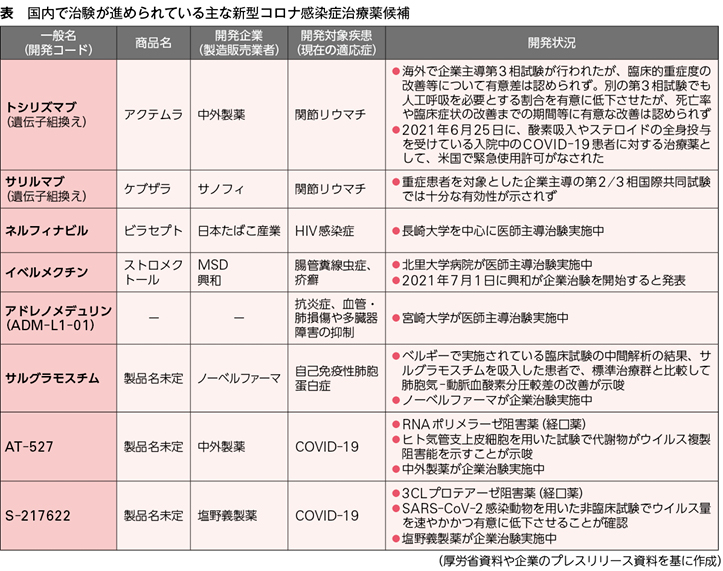
国内だけでもCOVID-19治療薬としての承認を目指し多くの治験が進められている(表参照)が、他の疾患用に開発した(開発中の)製剤のCOVID-19への効果を検証するものが大半だ。その中で塩野義はCOVID-19をターゲットに据え、自社創製の経口抗ウイルス薬として、ウイルスの増殖に必須の酵素である3CLプロテアーゼを選択的に阻害する「3CLプロテアーゼ阻害薬」の開発を進めている。
塩野義によると、この薬剤はSARS-CoV-2感染動物を用いた非臨床試験で、ウイルス量を速やかかつ有意に低下させることが確認されているという。
「ブースターなしで長い半減期」
8月2日の説明会で澤田本部長は、先行して開発が進められている米ファイザーなどの経口抗ウイルス薬との違いとして「PK(薬物動態)についてブースターなしで長い半減期が得られている」点を強調した。
塩野義はCOVID-19治療薬についても国内への早期提供を目指し、年内に国内大規模臨床試験を開始する方針。澤田本部長は「グローバル開発の準備も並行して進め、早期に世界中に提供できるような生産体制の構築を進めていきたい」と、グローバル展開もにらんで開発と生産体制構築を急ぐ考えを示している。
日本の企業がCOVID-19治療薬の提供を通じて世界に貢献する日が来ることを期待したい。
【関連記事】














































