お知らせ
Delta株感染を克服する(第2部)─Delta株感染に対する現状ワクチンの効果,新たな治療法の模索[J-CLEAR通信(133)]

第1部で考察したように,Delta株は液性免疫回避変異を有し,感染性,病原性の増強が明らかにされた。このような病原性の高いDelta株制御のために,第2部では“現状ワクチンのDelta株に対する予防効果”と“Delta株に対する新たな治療法の模索”について考察する。
1 ワクチン接種後の免疫動態
(1)ワクチン接種後の液性免疫
中和抗体の中核をなすS蛋白に対する特異的IgG抗体を産生する形質細胞数は,2回目のワクチン接種後約1週間でピークに達し,3週間以内にその90%が消失する(短期生存形質細胞,short-lived plasma cell)。しかしながら,S蛋白特異的IgG抗体産生はワクチン接種後少なくとも8カ月にわたり持続することが判明しており,この現象は,免疫組織(脾臓,リンパ節)の胚細胞中心において形成されたS蛋白を特異的に認識する記憶B細胞に由来する長期生存形質細胞(long-lived plasma cell)によって説明される1)。

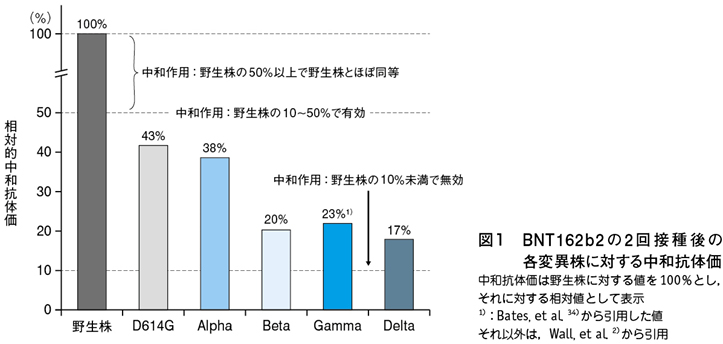
現状で使用可能なワクチンは武漢原株のS蛋白遺伝子配列をplatformとして作成されたものであり,S蛋白に複数の遺伝子変異を有するVOC(Variants of Concern)に対してどの程度の中和抗体を形成するかについては注意深い検証が必要である。Pfizer社のBNT162b2の2回接種後の変異株に対する中和抗体価は野生株を基準にすると,D614G株(従来株):43%,Alpha株:38%,Beta株:20%,Delta株:17%と報告された2)(図1)。一方,Moderna社のmRNA-1273の2回接種後の変異株に対する中和抗体価は従来株を基準として,Alpha株:83%(この値は従来株と有意差なし),Beta株:16%,Gamma株:29%であることが示された3)4)。野生株を基準としてBNT162b2とmRNA-1273のDelta株に対する中和抗体価を同時測定した結果ではBNT162b2:30%,mRNA-1273:33%であり,両mRNAワクチンのDelta株に対する中和抗体価は同等と考えられた4)。野生株に対する中和抗体価を基準として中和抗体価が50%以上に維持されていれば野生株に対する有効性とほぼ同等,10~50%に維持されていれば有効,10%未満なら無効と判断されるので5),VOCとして分類される4種の変異株に対するmRNAワクチンの中和作用は低下しているものの,ある程度のレベルには維持されており無効というわけではない。
BNT162b2接種後における各中和抗体価の時間推移はD614G株,Alpha株で時間経過にかかわらずほぼ一定値に維持されるのに対し,Beta株,Delta株では時間経過とともに低下し,少数例ではあるが100日後の中和抗体価が検出限界以下になる症例が認められた2)。これらの結果はAlpha株には強力な液性免疫回避作用を惹起する遺伝子変異が存在しないが,Beta株,Gamma株ではE484K変異,Delta株ではL452Rを中心とする液性免疫回避変異が存在することから説明可能である。
各変異株に対する中和抗体産生の程度はワクチンによって異なる。BNT162b2とmRNA-1273による同一ウイルスに対する中和抗体価は1回接種後も2回接種後もmRNA-1273の場合に高値であり,さらに,BNT162b2の中和抗体価が負の年齢依存を示すのに対しmRNA-1273では年齢依存を認めない6)。これらの結果を単純に解釈すれば,同じmRNAワクチンであってもBNT162b2に比べmRNA-1273のほうが液性免疫原性の面で優れていることを意味する。しかしながら,この場合に考慮しなければならない事実は両ワクチン接種を介して生体に導入されるmRNA量の違いである。BNT162b2では30μg,mRNA-1273では100μgを筋注する。すなわち,投与されるmRNA量はmRNA-1273でBNT162b2に比べ3.3倍高く,この投与量の差が中和抗体価の差を招来している可能性が高い。この考えの妥当性を支持する知見として全身・局所における一般的副反応の頻度もmRNA-1273接種後に高いことが報告されている7)。













































