お知らせ
第193回通常国会で成立した法律で医療・介護はどう変わる?【まとめてみました】
第193回通常国会が150日間の会期を終えて6月18日に閉会した。この国会で成立した医療・介護関連の法律は、臨床研究法、次世代医療基盤法、改正介護保険法、改正医療法、改正厚生労働省設置法の5つ(表1)。改正医療法についてはNo.4860で紹介したので、本号ではそれ以外の法律を概説する。


臨床研究法─利益相反を管理
臨床研究法は、相次ぐ臨床研究の不正を受けて検討されていたもの(図1)。同法の対象となる「特定臨床研究」は、「未承認・適応外の医薬品等の臨床研究」と「製薬企業等から資金提供を受けた医薬品等の臨床研究」。観察研究は対象にはならない。
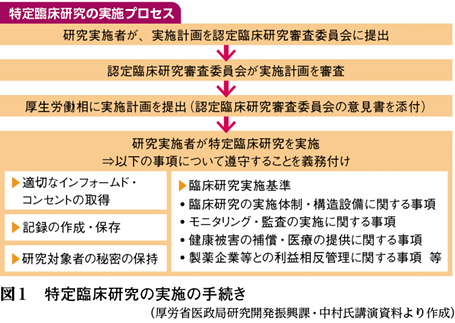
同法は研究実施者に対して、モニタリングや利益相反管理等に関する実施基準の遵守、記録の保存等を義務づける。臨床研究を行う際に研究実施者は、厚労相の認定を受けた「認定臨床研究審査委員会」に実施計画を提出し、同委員会が研究計画や有害事象対応を審査することも新しいプロセスだ。
さらに、臨床研究に関する資金提供の情報の公表を毎年度義務付ける。公表範囲は今後省令で規定するが、医政局研究開発振興課の中村彩子課長補佐は1日、都内で講演した際に、①自社製品の臨床研究費、②自社製品の研究実施者や研究実施者の所属機関に対する寄附金・原稿執筆料・講師謝礼金等(研究終了後2年以内も含む)─を検討していると説明。接遇費は対象とはしないものの、「(接遇費による)処方誘導がありうる」との考えを示し、接遇費を自主規制する業界団体と対応を検討しているとした。
同法の具体的な実施基準について厚労省は、今月中に厚生科学審議会に「臨床研究部会」を新設し、秋頃まで審議。12月のパブリックコメントを経て、来年1〜2月頃に省令を公布する予定。

残り1,130文字あります
会員登録頂くことで利用範囲が広がります。 » 会員登録する













































