お知らせ
■NEWS 新型コロナ治療薬候補「アビガン」、二重盲検で新たな治験開始―富士フイルム富山化学
富士フイルム富山化学は4月21日、新型コロナウイルス感染症(COVID-19)への効果が期待されている抗インフルエンザウイルス薬「アビガン錠」(一般名:ファビピラビル)について、COVID-19患者を対象とした新たな国内治験(臨床第3相試験)を開始したと発表した。


抗インフルエンザウイルス薬「アビガン錠」
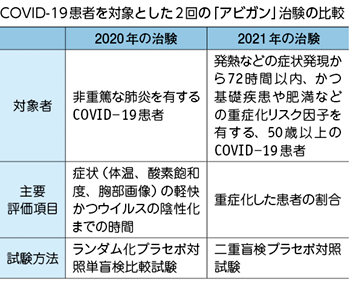
同社は2020年10月、国内治験のデータを基にCOVID-19の効能・効果追加の承認を厚労省に申請。しかし、12月の薬事・食品衛生審議会医薬品第二部会の審議で、治験が「単盲検試験」(ランダムに割り付けられた薬剤が実薬かプラセボか医師のみ把握できる試験)だったことなどが問題視され、「現時点で得られたデータから有効性を明確に判断することは困難」との理由で「継続審議」とされた。
■「重症化リスク因子を持つ患者」が対象、10月末終了予定
新たな治験は、「発熱などの症状発現から72時間以内、かつ基礎疾患や肥満などの重症化リスク因子を有する、50歳以上のCOVID-19患者」を対象に「二重盲検試験」(医師にも患者にも実薬かプラセボかを知らせずに行う試験)で実施する。「重症化した患者の割合」を主要評価項目として有効性を検証するとしている。
富士フイルムホールディングスによると、新たな治験の目標症例数は316例で、今年10月末終了の予定。
同社は、アビガンの国内治験を新たに開始した理由について「COVID-19で重症化するケースの多くが高齢者や、基礎疾患、肥満などの重症化リスク因子を持つ患者。昨年実施した国内治験で、特に発症早期の患者にアビガンを投与することで症状改善を早める効果が示唆されたことから、発症早期のCOVID-19患者を対象に重症化を防ぐことを目的とした国内治験を新たに始めることを決めた。継続審議となった理由に単盲検ということがあったので、今回は二重盲検で行うことにした」(広報担当)としている。
【関連記事】













































