お知らせ
臨床研究、「一定の範囲」法規制へ - 次期通常国会へ法案提出も、対象の意見集約できず [臨床研究論文不正問題]
【概要】ディオバンを巡る論文不正問題を受け、厚労省検討会が臨床研究に対し一定の範囲で法規制が必要とする報告書を取りまとめた。来年の通常国会での法制化を目指す。
ノバルティスファーマのARBディオバン(一般名=バルサルタン)を巡るデータ不正操作など一連の論文不正問題を受け、医師主導の臨床研究に対する法規制について検討していた厚労省の「臨床研究に係る制度の在り方に関する検討会」(遠藤久夫座長)は11月26日、「一定の範囲の臨床研究について法規制が必要」とする最終報告書を取りまとめた。
報告書は、臨床研究への信頼回復が重要と強調し、「我が国においても、5年後・10年後の将来を見越した上で、国際水準の臨床研究が実施できるような制度づくりが必要」と指摘。現行制度では不正対策に限界があるとした上で、倫理指針の遵守など研究者等による自助努力に加え、法制化が必要との結論に至ったとした。厚労省は来年の通常国会に法案を提出、法制化を目指す方針だ。
ディオバンの事例は規制対象外の可能性も
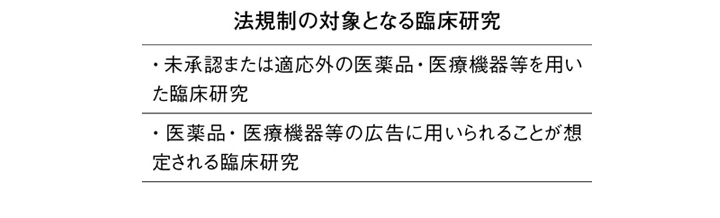
法規制の対象(別掲)となるのは、(1)未承認または適応外の医薬品・医療機器等を用いた臨床研究、(2)医薬品・医療機器等の広告に用いられることが想定される臨床研究─のいずれかに該当した場合。過度な法規制は研究の萎縮を招く懸念から対象を限定した。このうち、(2)は研究開始前にチェックすることを念頭に置いた表現となっている。つまり、ディオバンのケースと同様に、承認済の効能・効果を競合商品と比較する研究で、その優位性を示すためにデータの不正操作などが行われて広告に用いられた場合でも、事前に広告使用が想定されていない臨床研究であれば、規制の対象から除外される余地を残した表現となった。
ディオバンのケースが対象外となる可能性を孕むことについて、厚労省の医政局研究開発振興課担当官は「判断が難しい」との認識を示した。検討会では、広告に用いる場合、事前規制とするか事後規制とするかについての意見集約はできなかったが、厚労省担当官は本誌の取材に対し、「“広告の根拠となる研究”については法規制の対象とする方向で法制化を検討していく」と答えた。
学会、所属機関に「厳しい姿勢」求める
報告書では臨床研究の実施に際し、研究の質確保と被験者保護の観点から、「(国際基準の)ICH-GCP等を踏まえて、関係者にその遵守を求めるべき」と明記。ただし、費用負担の面から研究のリスクに応じて適切な方法・頻度を検討すべきとした。不正へのペナルティについては、ディオバンのケースで不正に関与した研究者に対する学会の処分が不十分、との指摘を踏まえ、「(不正に関与した)研究者が所属する研究機関や学会も厳しい姿勢で臨むよう自主的な取り組み」を求めた。
報告書はまとめとして、日本の臨床研究が信頼を取り戻すためには、「製薬企業等の産業界や行政等を含めた臨床研究にかかわる全てのものがそれぞれの果たす役割に真摯に取り組む必要がある」と強調した。
【記者の眼】今回の報告書で、臨床研究の法規制にメドが立ったことは評価できる。ただ、法規制の対象となることで頻発している研究不正に歯止めがかかるのかは未知数だ。せめて抜け道のないよう、法案では対象の研究が明確化されるような表現を期待したい。(T)