お知らせ
非劣性試験の正しい見方 [J-CLEAR通信(43)]
┃非劣性試験の登場
日本における過去の治験では,既承認薬との同等性試験がよく行われていた。そこでは,結果が非有意(not significant:n.s.)であることにより同等と結論していた。しかし,それは問題だということが言われるようになった。質の低い試験を,また少数例の試験を実施すると結論はn.s.になるからである。
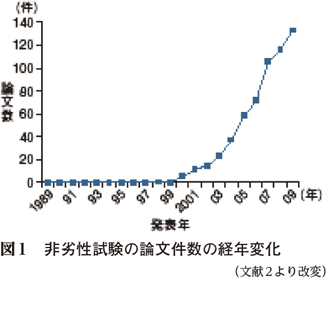
そこで,同等性試験の評価の見直しが行われるようになった。それは日米EU医薬品規制ハーモナイゼーション国際会議(International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use:ICH)の中に組み込まれ1),ICH-E10ガイドライン「臨床試験における対照群の選択とそれに関連する諸問題」として2000年に完成した。その際,同等性試験に加えて,非劣性試験という概念が登場した。その後,非劣性試験は急速に増え続けている(図1)2)。
┃非劣性の立証法
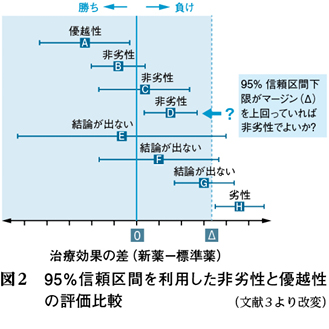
プラセボに対する優越性はゼロを起点に評価するが,標準薬に対する非劣性はマージン(Δ)を起点に評価する。図2 3)に示したように,95%信頼区間下限がゼロを超えていれば「優越性(superior)」,Δを超えていれば「非劣性(noninferior)」と評価する。これを見てすぐわかるように,非劣性のほうが立証するのは容易である。なぜなら,新薬群にΔ分を上乗せした上で標準薬群と勝負(検定)しているからである。

残り3,676文字あります
会員登録頂くことで利用範囲が広がります。 » 会員登録する









































