お知らせ
新型コロナウイルス間質性肺炎の本態は免疫介在性炎症性疾患である(高橋公太)

Point
COVID-19はその病態の進行度から主に4期に分けることができる
SARS-CoV-2間質性肺炎は免疫介在性炎症性疾患の一種であるので,免疫抑制作用や抗炎症作用のある副腎皮質ステロイドが有効である

はじめに
新型コロナウイルス感染症(COVID-19)の流行が世界中をかけめぐり,いまだ終息のめどが立たない。さらに感染力の強い変異株も出現して猛威を振るっている。
COVID-19は天然痘のように,この地上から撲滅することはきわめて難しいので,その予防としてワクチン接種を普及させ接種率を上げて,集団免疫を獲得することが最善の方法である。しかし,COVID-19が発症した場合でも,その症状を軽減させ,重症化を防ぐことができればよい。そのためにはこの間質性肺炎の発症メカニズムとその病態を理解することが何よりも重要な鍵となる。
筆者は,本誌『識者の眼』欄にCOVID-19について移植医の立場からその見解を3部作にまとめて発表した1)~3)。しかし,紙面の都合により十分にCOVID-19について説明できなかったので改めて本稿で紹介したい。
1. 移植医とCOVID-19の関わり
生体防御機能調節とCMV感染症
我々団塊世代の移植医は,古典的なアザチオプリンをベースにした免疫抑制療法と,当時としては新薬であったシクロスポリンをベースにした免疫抑制療法との過渡期を過ごした。この薬剤の変遷により,移植後の感染症の主な病原体は,細菌や真菌からウイルスへと移行した。しかし,その検査法や抗ウイルス薬はまだ限られていたので,臓器移植や骨髄移植の分野では,1980年代,しばしば重篤なサイトメガロウイルス(cytomegalovirus:CMV)間質性肺炎が発症し,移植臓器は生着するものの,多くの尊い命が失われた1)4)~11)。
腎移植を数千例手掛けてきた筆者は,移植後の拒絶反応や合併症を数多く経験してきた。腎移植の免疫抑制療法は移植直後,拒絶反応を抑制するために高用量のステロイドをはじめとした強力な免疫抑制を実施し,その後,臨床経過をみながら免疫抑制薬を漸減し,数カ月後には少量の維持量にするのが一般的である。この移植導入期の強力な免疫抑制下にCMVの感染を受けるとウイルスは増殖を始めるが,患者の免疫機能が一番低下した時期に間質性肺炎は発症せず,予想に反して免疫抑制を軽減したタイミングで間質性肺炎を発症し急激に増悪する。その発症メカニズムが,新型コロナウイルス(SARS-CoV-2)間質性肺炎の発症メカニズムときわめて酷似している5)6)10)11)。
筆者は,これらの経験が少しでもこの新興感染症であるCOVID-19の治療に応用できるのではないかと考え,筆を執った。
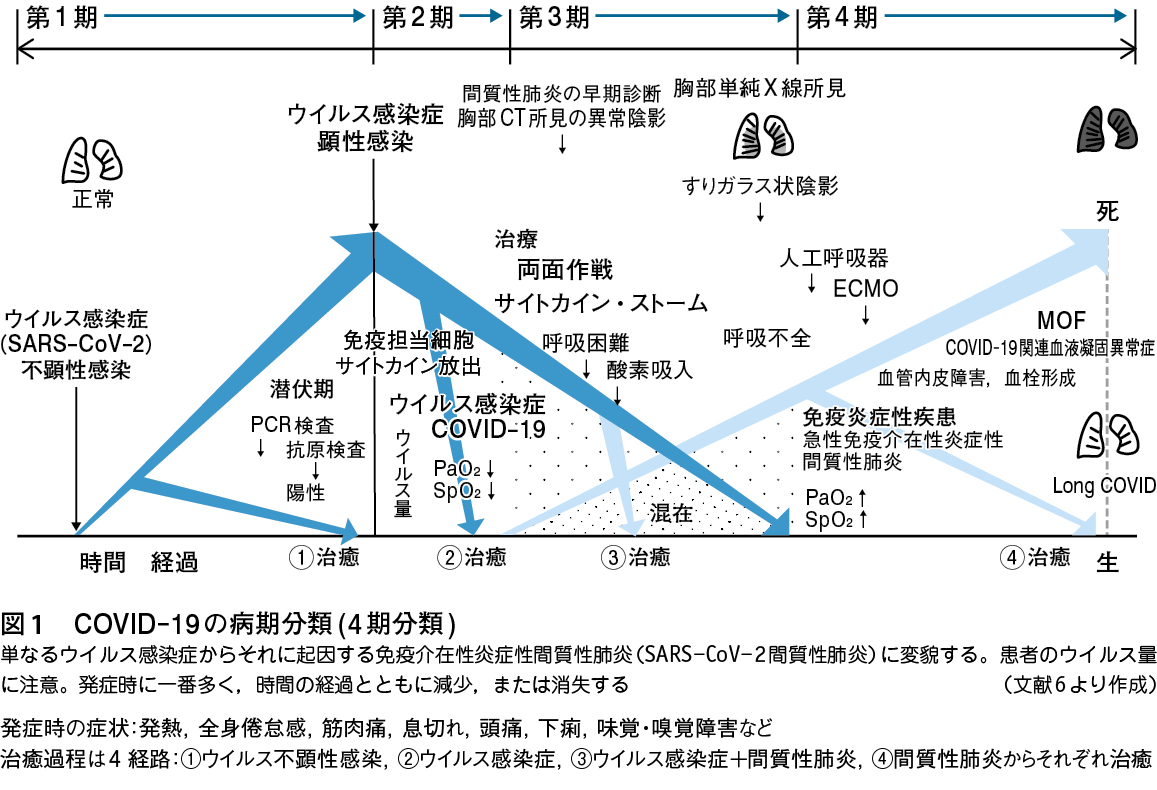
2. COVID-19における病態の進行度による分類(図1)
COVID-19をよく観察してみると,「1つの病態に始まり,やがてもう1つの異なる病態が生まれ重なり競い合って,また1つの病態に豹変する」。この流れを医学的に解析し,COVID-19の病態の進行度に沿って分類してみると次の4期に分けることができる。
第1期:不顕性ウイルス感染 潜伏期 無症状
第2期:顕性ウイルス感染 感冒症状
第3期:ウイルス感染症と免疫介在性炎症性間質性肺炎との混在
第4期:進行した間質性肺炎 ウイルス量減少,または消失
である(図1)6)。
3. SARS-CoV-2間質性肺炎の発症メカニズム
病態がウイルス感染症から免疫介在性炎症性疾患に変貌し重篤化する
SARS-CoV-2間質性肺炎の発症メカニズムとその病態について,筆者が苦い経験をしたCMV間質性肺炎とSARS-CoV-2,COVID-19に関する最新の文献から次のように考える1)〜16)。
宿主がある一定量のSARS-CoV-2に暴露されると,このウイルスの標的受容体であるアンジオテンシン変換酵素Ⅱ(ACE2)が多く発現している気道上皮細胞や肺胞上皮細胞に接着侵入し感染する(第1期)。1日~2週間の潜伏期を経て,発熱,全身倦怠感などの感冒症状を主訴として発病する。この時期がウイルスの増殖が最も旺盛で,患者のウイルス量が一番多いことが報告されている。したがって,この発症前後が第三者に感染を拡大させるもっとも危険な時期でもあり,原則として患者本人の治療はもちろんのこと,第三者に感染させないため入院隔離が必要となる(図1)(第2期)2)6)13)。
初期の病態は,ウイルスの侵入によりウイルス感染症として発症する。やがてそのウイルスにより障害された感染細胞を回復するために,リンパ球を代表とする免疫担当細胞が動員される。その働きによりウイルスの増殖は抑制されるが,それでも免疫担当細胞の攻撃は収まらずサイトカインを過剰に放出し,サイトカイン・ストームが発生する。その結果,肺胞上皮細胞や間質を形成している細胞膜の透過性がかわり滲出機転が働き,硝子膜が形成され,肺胞中隔浮腫,肺胞壁の肥厚,線維化が進む。一方,肺胞嚢の含気性を保つサーファクタントを唯一産生する肺胞Ⅱ型上皮細胞も障害されるため,この分泌が減少し,その結果,肺胞の虚脱を招き,肺胞壁が重なり合って,これが画像診断上,すりガラス状陰影(ground-glass shadow)として反映される14)。すなわち,急性免疫介在性炎症性間質性肺炎(acute immune-mediated inflammatory interstitial pneumonitis)が発症する1)~6)。
それに伴い酸素のガス交換が不十分となり,組織に十分な酸素が供給されず,患者は呼吸苦を訴える。やがてウイルスと免疫担当細胞がせめぎ合い重なり合って様々な程度の病態が混在する(第3期)。さらに宿主の生体防御機能の働きにより,ウイルス量が減少,消失しても,その攻撃は歯止めがかからず間質性肺炎の病巣が急速に広がり,患者は重篤な呼吸不全に陥る(第4期)。
したがって,この時点で当然人工呼吸器や体外式膜型人工肺(extracorporeal membrane oxygenation:ECMO)の適応になるが,肺の病変がある程度進行しているため患者の予後は悪い。救命できても後遺症(Long COVID)が残ることが多い。
世間一般ではCOVID-19はウイルスが増殖する単なる感染症として強調され過ぎて,病態がすでに間質性肺炎に移行し,主役のウイルスがいつの間にか舞台からおりて,代役の患者自身の生体防御機能(免疫能)にすり替わって,おのれの肺組織を傷つけていることに気づいていない。実はここに治療の重大なポイントが隠されている1)~6)。
一部のCOVID-19患者がある日突然,病状が悪化することが報告されている。これはウイルスそのものが増殖しているのではなく,むしろウイルスに対して免疫防御機能が反応して,一瞬のうちに炎症が広範な組織に広がるからである。それを反映して胸部単純X線や胸部CT所見では,すりガラス状陰影やコンソリデーションが増大する。
呼吸機能の検査法としてPaO2(動脈血酸素分圧)の測定,または,患者に侵襲がないパルスオキシメーターを使用すれば,数秒にしてSpO2(動脈血酸素飽和度)を測定することができる。病状が進行すればSpO2が急速に低下し,病状が回復に向かえば速やかに上昇する。PCR検査の陽性,SpO2の低下,および胸部CT検査にてすりガラス状陰影所見のトリアスの条件がそろえば,SARS-CoV-2間質性肺炎の確定診断となる4)。
間質性肺炎患者の急激な病状の悪化と,治療が奏功すれば速やかな回復の経過をとる病態は,免疫介在性炎症性疾患の大きな1つの特徴である6)。
最近,SARS-CoV-2に感染しているにもかかわらず,息切れや呼吸困難を訴えることもなく,軽症と診断され自宅待機していた患者が低酸素血症で急死したという報道をしばしば耳にする。低酸素状態になると気持ちがよくなり,多幸感に浸る場合があり,以前から高山病やジェット・パイロットが遭遇する「幸せ低酸素血症(happy hypoxia)」と呼ばれる深刻な事態に陥ることがあるので注意を喚起したい4)。
間質性肺炎の病状が悪化すれば,患者はやがて急性肺障害や急性呼吸窮迫症候群(acute respiratory distress syndrome:ARDS)を伴う重篤な呼吸不全に陥る。また,SARS-CoV-2の標的受容体であるACE2は肺以外の臓器,脳,心,肝,腎,舌,鼻腔粘膜および消化管などにも存在するので,味覚・嗅覚障害,下痢,心房細動,肝障害,および意識障害などの多彩な症状がみられる。さらに,患者のそのときの生体防御機能の程度により,新たな病態であるCOVID-19関連血液凝固異常症や血管内皮障害が生じ,それに起因する血栓がさまざまな臓器に発生し,究極的には多臓器不全(multiple organ failure:MOF)や敗血症などを合併して死に至る15)。
4. SARS-CoV-2間質性肺炎の治療
「両面作戦」が必須
臨床的には,図1のように第2期と3期,および第3期と4期の境界領域はウイルス感染症と間質性肺炎が混在して重複しているので,明確に分けることは難しい6)。重症化しやすいSARS-CoV-2間質性肺炎の治療は急を要するので,間質性肺炎を認めたら病態が混在していると考え両面作戦を開始する。すなわち第1の治療は宿主(患者)の生体防御機能側の面からみた治療,第2は病原体ウイルス側の面からみた治療,これら両面からみた2つの治療が必須である5)6)。また,COVID-19関連血液凝固異常症や血管内皮障害より血栓症を合併する場合は,抗凝固療法も必要となる15)。
両面作戦の第1の治療は,免疫介在性炎症性疾患に対する治療である。迅速に一時的に宿主の過剰な生体防御反応を制御し,徐々に免疫能を上げることを目的にしている5)10)12)。具体的な治療としては副腎皮質ステロイドのデキサメタゾン(商品名:デカドロン®)の投与で,保険適用になっている。
ステロイド・パルス療法は,腎移植の黎明期から今日に至るまで一貫して急性拒絶反応の第1の治療法として実施されてきた。筆者はこのパルス療法がSARS-CoV-2間質性肺炎にも有効と考えており,それを勧める主な根拠を2つ挙げる3)6)。
1つ目の根拠は,間質性肺炎の病態と,移植患者の拒絶反応の病態が類似しているからである。間質性肺炎患者における,ウイルス感染症を契機に免疫担当細胞が感染した自己臓器(肺)を攻撃して発症する間質性肺炎と,移植患者における,これらの免疫担当細胞が同種移植片(腎)に浸潤して障害を与える拒絶反応の病態は,ある種の類似した免疫性炎症性反応(疾患)である3)6)。
ステロイドの投与がウイルスの増殖を助長するのではないかという懸念に対して,前述のように,患者のウイルス量は感染症発症時に一番多いことが報告されている13)。そして免疫担当細胞の働きによりサイトカイン・ストームが発生して,間質性肺炎が発症したときにはウイルス量は増加するのではなく,これらの働きにより逆に減少,または消失している。その証しとして,この時点で症例によってはしばしばPCR検査が陰性化していることが指摘されている。したがってパルス療法の適応の妨げにはならない2~6)8)。
また,過去の腎移植患者の中には同一時期にCMV感染症を契機に間質性肺炎と急性拒絶反応を合併した症例がある。これは必ずしも偶然に合併したものではない。CMV感染症がきっかけとなって細胞のclassⅠ抗原やclassⅡ抗原の発現が増強され,T cellの反応を刺激する。一方,classⅠ抗原はCMVのレセプターとして作用し,細胞のCMV感受性を強める結果,間質性肺炎と拒絶反応を惹起させる12)。したがって肺と移植腎には同様な免疫担当細胞が浸潤していると考え,免疫抑制や抗炎症効果のあるステロイドは有効である13)。
骨髄移植においても以前から同様にCMV間質性肺炎と移植片対宿主病(graft-versus-host disease:GVHD)が同時に発症する例が報告されている11)。
SARS-CoV-2間質性肺炎にステロイド・パルス療法が有効な2つ目の根拠として,肺の感染細胞を攻撃する免疫担当細胞は,未熟な細胞から成熟した細胞までその種類や分化過程が様々な細胞から構成されている。したがって未熟細胞は低用量のステロイドでも抑制されるが,成熟細胞を抑制するためにはある程度の高用量のステロイドが必要となる3)6)。
具体的に,腎移植患者の急性拒絶反応発症時のメチルプレドニゾロン(ソル・メドロール®)のパルス療法を紹介すると,1クールのパルス療法として本薬剤を1日目250~500mg,2日目125~250mg,3日目60mgを目安に投与し,以後原則として漸減せずに経過をみる。それでも効果がみられない場合には数回実施してきた。ただし,それ以上投与すると全身の組織にコルチコステロイドの受容体があるため,多彩な副作用や有害事象が発生するので,その投与には慎重な配慮が必要である3)5)6)。
両面作戦の第2の治療はウイルス側からみた治療で,SARS-CoV-2の増殖を抑制する抗ウイルス薬の投与である。わが国で保険適用されている薬剤は,唯一,静注薬レムデシビル(ベクルリー®)である。しかし世界保健機関(WHO)は,本薬剤が入院患者の死亡率を低下させるまでに至らなかったという結果から,この薬剤の使用は推奨しないという見解をとっている。
国産の期待の星,経口薬ファビピラビル(アビガン®)は,昨年実施した国内の治験データを補足するため,海外で実施された治験の結果が良好だったので,そのデータが加われば,近々保険適用になると期待された。しかし,わが国で今年新たに治験をやり直すことになった。最近,これも国産薬剤であるが,イベルメクチン(ストロメクトール®)の抗ウイルス効果も期待されている。
いずれの薬剤にせよ,多くの犠牲者が出ている現状を考えれば,SARS-CoV-2の経口治療薬がない現在,早急な適応拡大が望まれる16)。
以上の両面作戦の治療が奏功すれば,患者の血液酸素濃度はすみやかに上昇し,画像所見も好転し,患者も寛解に向かう。
5. 最後に読者に伝えたいこと
ウイルス,なかでも特にSARS-CoV-2はきわめて狡猾なウイルスである。今まで述べてきたようにCOVID-19は,SARS-CoV-2における単なるウイルス感染症ではなく,その盾の後ろにひた隠す切り札としておぞましい免疫介在性炎症性疾患を引き起こす武器を持っている。したがって,これら2種類の混在した病態を考えれば,抗ウイルス薬,またはステロイド薬に代表される免疫抑制薬のみの単独使用ではあまり効果がみられないのは当然の結果である。偉大な哲学者パスカルの言った「人間は考える葦である」という格言をもう一度思い起こしてほしい。要は考えることをするか,しないか次第である。
終わりに
移植分野に流行したCMV間質性肺炎の経験を生かしてSARS-CoV-2間質性肺炎の発症メカニズム,その病態と治療について述べた。そのときの教訓が,重症化するCOVID-19の治療に少しでも貢献できれば幸いである。
なお,本原稿における主な趣旨は,2021年2月17~19日まで開催された第54回日本臨床腎移植学会の30周年記念講演で述べた。
本原稿に関して企業などとの利益相反(COI)はない。
【文献】
1)髙橋公太:医事新報. 2021;5050:72.
2)髙橋公太:医事新報. 2021;5053:54.
3)髙橋公太:医事新報. 2021;5055:65.
4)髙橋公太:新型コロナによる肺炎は移植患者の感染症に酷似, 論座(朝日新聞), 2021.
[https://webronza.asahi.com/science/articles/2021022200005.html]
5)高橋公太:腎と透析. 2020;89(4):735-43.
6)高橋公太:腎と透析. 2021;90(1):289-301.
7)Takahashi K, et al:Transplant Proc. 1987;19:4089-95.
8)高橋公太, 他:日泌尿会誌. 1989;80:175-84.
9) 高橋公太, 他:今日の移植. 1992;5:287-91.
10) 高橋公太, 編:臓器移植におけるサイトメガロウイルス感染症. 日本医学館, 1997.
11) Grundy JF, et al:Lancet. 1987;2:996-9.
12) Takahashi K:ABO-incompatible kidney transplantation. Elsevier, 2001.
13) To KK, et al:Lancet Infect Dis. 2020;20(5):565-74.
14) 北岡裕子:COVID-19肺炎における肺胞虚脱. m3.com, 2020.
[https://www.m3.com/open/clinical/news/article/853694]
15)日本内科学会:日内雑誌. 2020;109:2257-363.
16)白木公康:医事新報. 2020;5036:30-7.