お知らせ
医薬品の市販後安全対策─大規模リアルタイム医療情報データベースの構築 [J-CLEAR通信(58)]
2004年4月に設立された医薬品医療機器総合機構(Pharmaceuticals and Medical Devices Agency:PMDA)は,医薬品,医療機器,再生医療等製品などの市販前承認審査,市販後安全対策および健康被害救済を三大業務とする,厚生労働省所管の独立行政法人である。本稿では,医薬品の市販後安全対策の最近の話題をご紹介したい。
安全性情報の提供のあり方 ─防止・早期発見のための病薬連携─
医薬品の承認までに得られる情報は限られていることから,市販後に予期しない重篤な副作用が見つかることも少なくない。PMDAでは,医薬品医療機器法に基づいて副作用症例の報告を収集・評価し,新たに得られた安全性情報を医療現場にフィードバックしている。年間4万件以上の副作用症例が報告され(図1),これらをもとに添付文書の改訂などの安全対策を年間130件以上講じている。


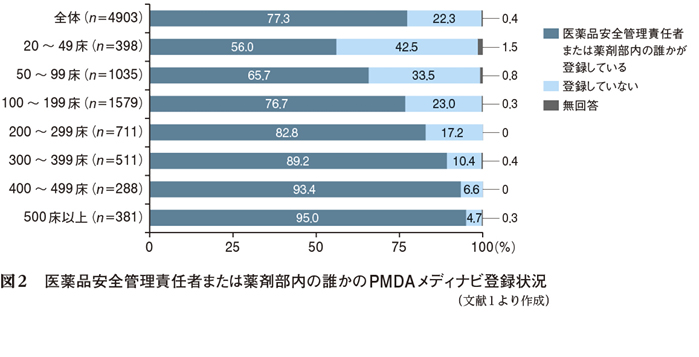
副作用症例の多くは製薬企業経由で報告されるが,医療機関から直接報告される情報も貴重な情報源となっている。評価・検討された安全性情報をいかにひとりひとりの医師,薬剤師などの医療関係者に届け,それを活用してもらうかが重要である。そこでPMDAでは,安全性情報を迅速に医療の現場に届けるため,メール送信サービス「PMDAメディナビ」を運用している。PMDAが平成26(2014)年度に全国の病院を対象に行った調査(図2:約4900病院が回答,回答率57.8%)によれば,77.3%の病院でPMDAメディナビの登録者がいる。未登録施設にあってはこの機会にぜひ登録をお願いしたい(図2のQRコードまたは「PMDAメディナビ」検索)。


残り1,488文字あります
会員登録頂くことで利用範囲が広がります。 » 会員登録する






































