お知らせ
(2)骨形成促進薬の展望 [特集:進化する骨粗鬆症治療]
骨再構築における骨形成は反転相での前駆細胞のリクルートと骨芽細胞分化により制御される
骨芽細胞分化の制御には古典的Wntシグナルが重要である

力学的負荷やPTHはスクレロスチンの発現抑制を介してWntシグナルを促進する
PTHは骨再構築を促進し骨代謝回転を高めるとともに骨形成を促進する
抗スクレロスチン抗体はWntシグナルの促進を介し強力な骨形成促進作用を示す
1. 骨再構築系の制御と骨形成
骨は常に再構築を繰り返すことにより,その構造・量および強度を維持している。そして,古く劣化し強度が低下したり損傷を受けた場所に破骨細胞が誘導され骨吸収が営まれると,数週間の反転相を経て骨吸収面に骨芽細胞が現れ骨形成が進行する。骨再構築系における骨吸収と骨形成とのバランスは,力学的負荷や副甲状腺ホルモン(parathyroid hormone:PTH)により正に傾く一方,加齢や閉経,グルココルチコイド過剰などにより陰性化する。この再構築バランスと反転相巾との間には密接な関係がみられており,反転相での骨芽細胞系細胞のリクルート過程の制御が平衡関係の維持に重要と思われるが,骨芽細胞系細胞の由来やリクルートの制御機構などを含め,なお不明な点が多い。したがって,新たな治療標的としては骨芽細胞前駆細胞の分化制御に中心的役割を占める古典的Wntシグナルに関わる分子が中心となっている。
古典的Wntシグナルの重要性は,これに関わる受容体遺伝子やWntシグナル伝達を阻害するスクレロスチンの遺伝子異常により著明な若年性骨粗鬆症や骨硬化症を呈する患者が存在することなどから明らかとなった。本稿では,骨再構築系の制御に関する最近の知見を整理するとともに,古典的Wntシグナルを介する骨形成の制御とその異常,そして抗スクレロスチン抗体を用いた新たな骨形成促進薬の展望について述べる。
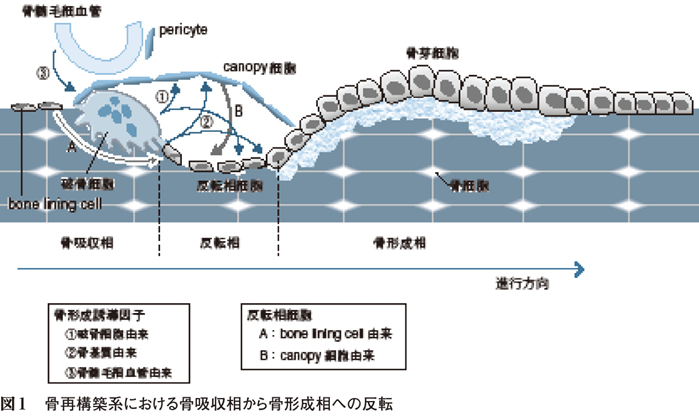
2. 骨再構築系における骨吸収から骨形成への反転(図1)
骨再構築は,破骨細胞による骨吸収により開始され,骨吸収面に新たに骨形成系細胞が遊走し骨形成が開始される。骨吸収を営む破骨細胞はcanopy(天蓋)細胞と呼ばれる間葉系由来の細胞で覆われている。これらcanopy細胞は骨髄の包皮(envelope)を形成し活発に細胞分裂するとともに,骨芽細胞への分化能を有している。また骨表面のbone lining cell(BLC)と類似しているが自らは骨表面と接触せず,破骨細胞と骨再構築面を覆っている。
一方でcanopy細胞は骨髄腔側の毛細血管と密接に接触し,細胞の供給を受けるとともに骨形成促進因子の作用下で骨芽細胞へと分化する。すなわちcanopy細胞の起源としては,BLCに由来するものと骨髄毛細血管から供給されるものがあると考えられる1)。
破骨細胞が骨吸収を営んだ後の反転相表面は反転相細胞(reversal cell)が覆い,自らmatrix metalloproteinase(MMP)を分泌し骨の露出基質表面を整えるとともに,cement lineの形成も営むと考えられる。これらの反転相細胞はマクロファージ系細胞との説もあったが,間葉系の骨芽細胞前駆細胞との説が有力である。反転相細胞はBLCとcanopy細胞の両者からリクルートされて形成され,骨表面で細胞分裂することなく骨芽細胞へと分化する。そして,骨形成相への移行には多数の反転相細胞の集積が必要であり,これらが骨芽細胞へと分化し,一定数以上に達することで骨形成が開始される1)。
こうして,破骨細胞を覆うcanopy細胞とBLCから供給された間葉系細胞が骨形成を営む骨芽細胞へと分化することで,骨吸収面に選択的に骨芽細胞前駆細胞が集積し骨形成が開始されることになる。反転相は通常4週間程度で骨形成相へと移行するが,ビスホスホネート製剤投与後や骨リモデリング平衡が破綻し骨形成が低下した状態では,反転相細胞の集積が不十分となり反転相が延長するとともに骨形成が不十分となる2)。

残り4,636文字あります
会員登録頂くことで利用範囲が広がります。 » 会員登録する














































