お知らせ
【Breakthrough 医薬品研究開発の舞台裏(8)松井 俊勝/篠澤 忠紘(武田薬品工業 薬剤安全性研究所)】iPS心筋細胞を活用し抗がん剤の心毒性を予測、がん患者のQOL向上に貢献

診断技術や治療薬の進歩でがん患者の5年生存率が飛躍的に上昇する中、臨床現場では、抗がん剤長期投与による心血管合併症、特に心毒性が新たな問題として浮上。製薬企業においては、抗腫瘍効果の高い抗がん剤の開発のみならず、抗がん剤による心毒性を早期に予測し、心血管系への影響の少ない薬剤の候補を見つけることが大きな課題となっている。このほど、ヒトiPS細胞由来心筋細胞を用いて「抗がん剤による心毒性を予測する細胞評価系」を構築することに成功した武田薬品工業薬剤安全性研究所の松井俊勝主任研究員と篠澤忠紘主席研究員に、今回の研究成果の意義と今後の課題について話を聞いた。


まつい としかつ:2003年京大大学院農学研究科修士課程修了、武田薬品工業入社。医薬研究本部循環代謝創薬ユニットなどを経て、17年4月より薬剤安全性研究所主任研究員。
しのざわ ただひろ:2005年東北大大学院農学研究科応用生命科学専攻修了、武田薬品工業入社。17年10月より薬剤安全性研究所主席研究員、T-CiRA Discovery主席研究員(兼務)。
心毒性を高確率で予測することに成功
─このほど他社に先駆けて「抗がん剤による心毒性を予測する細胞評価系」の構築に成功したということですが、研究成果の概要を教えてください。
松井 抗がん剤は多かれ少なかれ心血管系に対し毒性があることから、Cardio-Oncology(腫瘍循環器学)の研究が世界的に注目されています。その中で私たちは、心血管系への影響の少ない抗がん剤を開発するためには、in vitroで心毒性を予測する細胞評価系を構築する必要があると考えました。
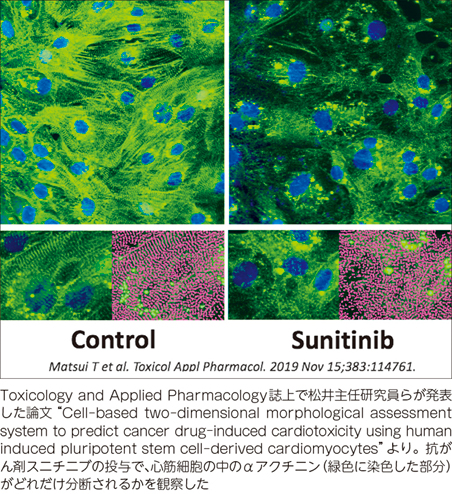
今回の研究では、市販されているヒトiPS細胞由来心筋細胞(iPSC-CMs)を用いて抗がん剤で構造異常が起こるかどうかを調べ、それを定量的に数値化することで、抗がん剤による心毒性を高確率で予測する評価系を構築することに成功しました。
抗がん剤を含む28種類の薬剤でテストしましたが、私たちが構築した評価系は、臨床に用いられる濃度で心毒性が起こるといわれている16種類の薬剤のうち13種類を陽性と認識し、臨床に用いられる濃度では心毒性は起こらないとされる12種類についてはすべて陰性と判断することができました。
研究成果については毒性学の専門誌「Toxicology and Applied Pharmacology」で発表するとともに、今年9月に開かれた日本腫瘍循環器学会学術集会でも発表しましたが、腫瘍内科や循環器内科の先生方に興味を持っていただき、「もう少し詳しく知りたい」「共同で何かできないか」などの声をいただいています。
他社も使えるよう論文を公開
篠澤 薬剤安全性研究所は、患者さんに投薬する前に薬剤の安全性を評価することを目的に研究を進めています。今回構築した評価系を使えば、弊社のみならず、抗がん剤の開発に取り組む他社も安全性の高い薬の開発を進めることができますので、がん患者さんのQOL向上に大きく貢献できると考えています。
─他社でも同じ評価系を構築できるように論文をオープンにしていると。
篠澤 この評価系について知的財産権は取っていません。世の中に安全性の高い薬が提供されるための評価系として広まっていくことを願っています。
弊社では、オンコロジーだけでなく、ニューロサイエンス領域や消化器系疾患領域の新薬開発でも、心血管系への影響が懸念される場合などにこの評価系を利用しています。
バイオマーカーの開発へ
─いまはどのような課題に取り組んでいるのですか。
松井 今回の研究を、抗がん剤誘発心毒性を早期に発見するバイオマーカーの開発に活かしたいと考えています。それに成功すれば、バイオマーカーを指標にした創薬研究も可能になると思っています。
篠澤 私たちのチームは、ヒトiPS細胞だけでなく、AIなども含め新しいテクノロジーを活用し、医薬品研究開発のできる限り早い段階でヒトにおける副作用を把握できるようにしたいと考えています。
臨床試験においてはフェーズ1で被験者の方に薬を服用してもらいますが、ヒトに投与する段階ですので、そこで副作用が起きてはいけない。その意味で私たちの研究は最後の砦だと考えています。
─抗がん剤に限らず、あらゆる領域でヒトを対象とした臨床試験に入る前にリスクを予測し、安全性の高い新薬開発を進めるのは意義のあることですね。
篠澤 画期的な新薬の開発を進めていても、臨床試験で100人に1人、1000人に1人に毒性が出て開発を中断するというケースがよくあります。その結果、有望な薬が多くの患者さんに届かず、長期間待たせることになり、企業にとっても開発費用が膨らんでしまうことになります。その意味でも、治験に入る前にリスクを予測することは大きな意義があると思っています。
副作用が出やすい人を見極めるツールを
─将来的にここまで成果を出したいという目標はありますか。
松井 抗がん剤を投与するときに、この患者さんは構造変化が起こりやすい、構造変化が起こりにくいという判断が、その患者由来のiPS細胞を用いて事前に予測できるようになればいいなと思っています。
篠澤 同じ薬でも効きやすい人と効きにくい人がいるように、副作用も出やすい人と出にくい人がいる。そこを見分けられるようなツールもしくはバイオマーカーをつくっていきたいですね。
─今回の研究で、低濃度で構造異常が起こるという結果が出た抗がん剤でも、患者さんによって起こりやすさは異なるのですね。
松井 心血管系の既往歴のある患者さんや放射線治療を受けている患者さんは、化学療法が加わると心毒性を引き起こしやすいとよくいわれていますし、遺伝的背景も影響しているかもしれないという報告もあります。この分野の研究はまだまだ継続して積み重ねていく必要があると思っています。