お知らせ
特集:心不全に併存する貧血へのアプローチ


2013年札幌医科大学医学部卒業。22年北海道大学大学院医学研究院博士課程修了〔博士(医学)〕,同年より現職(中尾,写真も)

1 心不全における貧血の意義
・貧血状態では複数の代償機構が機能する。
・代償機構のうち,交感神経系やレニン-アンジオテンシン-アルドステロン(RAA)系の亢進は,心不全患者においては心不全増悪の原因となる。
・貧血は心不全患者において全死亡や心不全入院の独立危険因子である。
2 赤血球の分化とヘモグロビンの生合成
・恒常性維持のためのヘモグロビンの生合成には20mg/日の鉄を必要とする。
・鉄代謝の把握には血清フェリチン濃度とトランスフェリン飽和度(TSAT)が主に用いられる。
3 心不全における貧血の成因
・心不全に合併する貧血の原因としては,血液希釈,内因性エリスロポエチンの産生低下,慢性炎症,RAA系の亢進,栄養障害および消化器疾患による鉄欠乏などが関与している。
・鉄欠乏には,全身の鉄が減少している絶対的鉄欠乏と,全身の鉄は正常または増加しているが,貯蔵プールに鉄が貯留しているために標的組織に十分な鉄が供給されない機能的鉄欠乏がある。
4 心不全における鉄欠乏
・鉄はミトコンドリアを介した心筋におけるエネルギー産生や骨格筋機能の低下などに関与するため,鉄欠乏は貧血の有無にかかわらず不良な予後と関連する。
5 心不全における貧血および鉄欠乏への介入
・すべての心不全患者に,血球数,血清フェリチン濃度,TSATによる貧血および鉄欠乏のスクリーニングを定期的に行うことが推奨されている。
・鉄欠乏に対する静注鉄剤の予後改善効果が期待されている。
1 心不全における貧血の意義
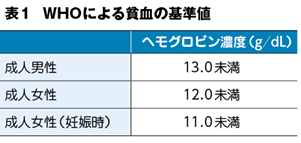
貧血は,循環している赤血球総量が著明に低下した状態と定義される。赤血球総量の測定は容易ではないため,一般的には世界保健機関(World Health Organization:WHO)の貧血基準に基づき,ヘモグロビン濃度を用いて診断される(表1)。ヘモグロビン濃度が低下した状態では,Fickの方程式(酸素供給=心拍出量×ヘモグロビン濃度×動静脈酸素飽和度較差)で示されるように,体組織への十分な酸素供給が障害される。
貧血下では,酸素供給を維持するために複数の代償機構が機能する。まず,赤血球の2,3-ジホスホグリセレートレベルが上昇し,ヘモグロビンの酸素親和性が低下するため,酸素結合曲線が右側へシフトする(図1)。これにより,動静脈酸素飽和度較差を上昇させることで酸素供給を維持する。
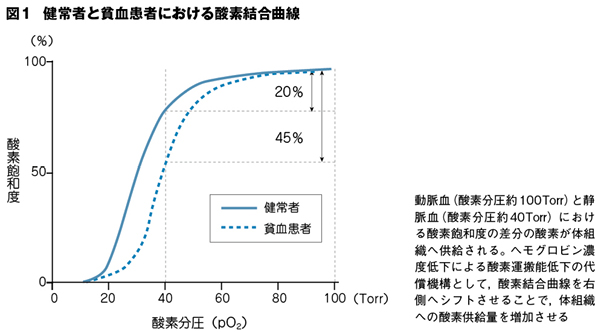
また,心拍出量を増大させることで,重要臓器への酸素供給を維持する。循環赤血球量の減少は血液の粘性低下により全身の血管抵抗を減少させ,また一酸化窒素を介した血管拡張を促進し,後負荷を下げる。動脈圧の低下により圧受容器を介して交感神経系やレニン-アンジオテンシン-アルドステロン(renin-angiotensin-aldosterone:RAA)系の亢進が生じる。これにより前負荷および心収縮力が増大し,心拍出量が増大する。しかし,心不全患者では,この代償機構が長期間持続すると心不全増悪の原因となる。
心不全患者における貧血の合併率は,左室駆出率にかかわらず,慢性心不全患者では30%以上,心不全増悪による入院患者では50%以上であり,一般集団(10%)と比較して高率である1)。また,貧血は心不全患者における全死亡や心不全入院の独立危険因子とされている。15万人以上の慢性心不全患者を対象とした33研究のメタアナリシスにおいて,定義は研究ごとに異なるものの,貧血の合併は全死亡の独立危険因子であった〔調整オッズ比:1.96,95%信頼区間(CI):1.74〜2.21〕2)。さらに,ヘモグロビン濃度と死亡率の関係は,直線的ではなくJ字型であることが報告されている。左室駆出率40%以下の慢性心不全患者約3000例を対象とした米国の研究では,へモグロビン濃度と2年生存率はJ字型の相関を示しており,ヘモグロビン濃度の低下は高い死亡率と関連することに加え,ヘモグロビン濃度14.5~15.4g/dLにおける生存率が最も良好であることも明らかとなった3)。貧血を合併した慢性心不全であっても経時的に貧血が改善した場合,死亡率は貧血を有さなかった患者と同等であると報告されており4),貧血合併慢性心不全患者における貧血に対する介入は予後を改善させることが期待される。