お知らせ
(3)GISTの化学療法 [特集:消化管癌外科治療における化学療法]

GISTは,消化管間葉系細胞がKITおよびPDGFRα遺伝子の機能獲得型変異により増殖能を獲得し腫瘍化したものである
分子機構の解明に伴い,分子標的治療薬であるイマチニブ,スニチニブ,レゴラフェニブの3剤が臨床開発され,切除不能また転移性GISTに対しきわめて高い治療効果を示し飛躍的な改善を示した

術後補助化学療法の全生存期間への寄与が示され,完全切除後の再発ハイリスク症例に対する3年間の術後補助化学療法が推奨され,さらなる治療成績の向上が期待される
1. 消化管間質腫瘍(GIST)とは
GIST(gastrointestinal stromal tumor)は,発症頻度が10万人に1〜2人と比較的稀な中胚葉由来間葉系腫瘍である。その発生母体は,消化管筋層の中に存在する消化管蠕動運動のペースメーカーとなるカハール介在細胞(interstitial cells of Cajal:ICCs)に異常が起きて腫瘍となったものと考えられており,胃(60%),小腸(30%)を含む食道から直腸までの全消化管に発生する。切除可能GISTの治療の第一選択は外科的完全切除であり,根治治療である。
一方,近年その腫瘍の発生原因が受容体型チロシンキナーゼであるKIT蛋白の機能獲得型の遺伝子変異であることが示され1),またこうした病因をもとに開発,臨床応用された分子標的治療薬(チロシンキナーゼ阻害薬)の成功2)から,脚光を浴びている腫瘍である。
2. GISTの発生機構と分子標的治療
ICCsはスペインの神経組織学者であるCajalによって消化管筋層,特に筋間神経叢の神経節周囲に密に分布する細胞群として発見された。その働きは消化管運動の調節にあり,1992年にICCsにKITが発現していること3)が,1998年にGISTの大部分がKITを発現していることが報告され1),現在ではGISTの細胞起源はICCsと同じであると考えられている。
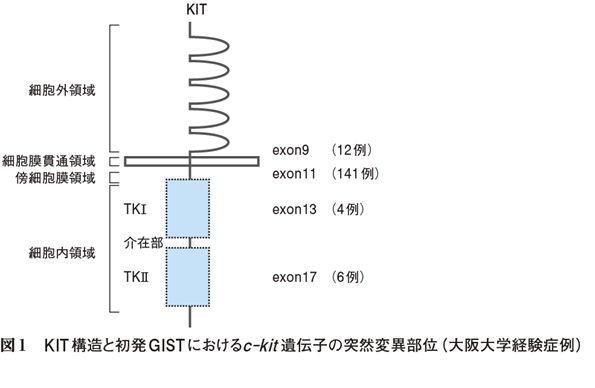
KITはc-kit遺伝子にコードされた1回膜貫通型の受容体型チロシンキナーゼで,免疫グロブリン様領域よりなる細胞外と細胞内に2つのキナーゼ領域,そしてこれをつなぐ細胞膜貫通領域からなる(図1)。正常では,リガンドであるstem cell factorが結合することで,受容体が二量体を形成し,細胞内ATPにより自己リン酸化を起こし,下流のシグナル伝達系(STAT系,MAP系,PI3K系)の活性化が生じ,増殖分化へと働く。多くのGISTにおいて,c-kit遺伝子の機能獲得型の突然変異が認められ(図1),この約80%がc-kit遺伝子の傍細胞膜領域(exon11)に,約10%が細胞外領域(exon9)に存在する。また,キナーゼ領域Ⅰ(exon13)あるいはⅡ(exon17)に突然変異がみられることもあるが,非常に稀である。c-kit遺伝子変異を認めずKITの発現が少ないGISTでは,KITと同じチロシンキナーゼファミリーに属する血小板由来増殖因子受容体α(platelet-derived growth factor receptor α:PDGFRα)が強く発現しており,さらにはPDGFRα遺伝子の傍細胞膜領域(exon12)あるいはキナーゼ領域Ⅱ(exon18)に機能獲得性突然変異がみられることが報告された4)。
こうして,GIST化の中心的機序は,KITもしくはPDGFRα遺伝子の変異による構造変化に伴う自己リン酸化,自己増殖シグナルの持続であることが発見され,このシグナルを抑制することによる腫瘍抑制効果が期待された。イマチニブはKITやPDGFRαのATP結合部位を競合的に阻害することでチロシンキナーゼ活性を阻害し,下流へのシグナルを遮断することが明らかになった。この分子機構に基づく治療は,Joensuu5)らにより著効例が報告され,同時にGISTに対する治療開発が開始された。

残り4,503文字あります
会員登録頂くことで利用範囲が広がります。 » 会員登録する