お知らせ
第160回:GLP-1受容体作動薬,その適用と注意点,エビデンスからの検証
- 登録日:
- 2023-11-22
- 最終更新日:
- 2024-11-19
執筆:住谷 哲(大阪府済生会泉尾病院 糖尿病・内分泌内科主任部長)
1 はじめに
glucagon-like peptide-1(GLP-1)受容体作動薬はDPP-4阻害薬と同じインクレチン関連薬として開発された。現在わが国では,注射薬としてエキセナチド(バイエッタ®,以下エキセナチドBID),リキシセナチド(リキスミア®),リラグルチド(ビクトーザ®),デュラグルチド(トルリシティ®),セマグルチド(オゼンピック®),経口薬としてセマグルチド(リベルサス®)が使用可能である。エキセナチド週1回製剤(ビデュリオン®,以下エキセナチドER)は,わが国では2022年5月に販売中止となった。さらに,リキシセナチドおよびリラグルチドは持効型インスリンとの配合製剤(ソリクア®およびゾルトファイ®)も発売されている。
本稿ではこれまでに報告されたランダム化比較試験および,それらのメタ解析の結果に基づいて,現時点におけるGLP-1受容体作動薬の適用および注意点を検証する。さらに,厳密にはGLP-1受容体作動薬ではないが,最近販売が開始されたGIP(glucose-dependent insulinotropic polypeptide)/GLP-1受容体作動薬であるチルゼパチド(マンジャロ®)もGLP-1受容体作動薬として本稿の対象に含める。
2 血糖降下薬として
すべてのGLP-1受容体作動薬は,それぞれの臨床開発プログラムにおいて有効性および安全性が検討された(表1)。すべてグローバル試験であるが,日本市場の重要性を反映して日本人のみを対象患者とした試験も実施されている。
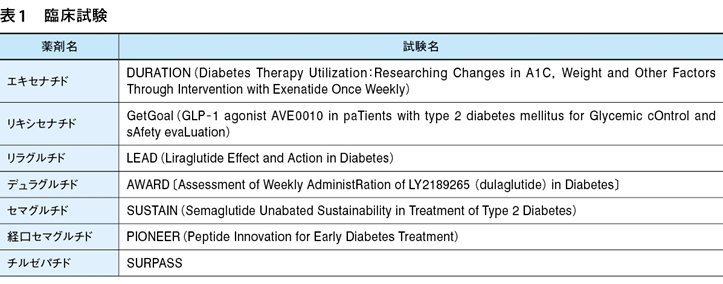
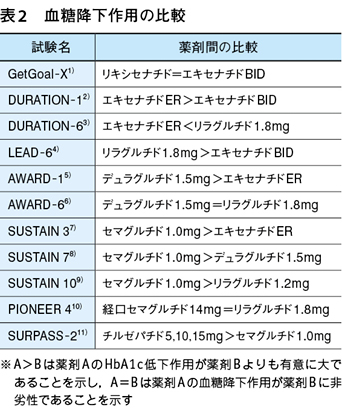
それぞれのGLP-1受容体作動薬間の血糖降下作用の比較は,いくつかの試験で検討された。結果を列記すると表2 1)〜11)の通りである。血糖降下作用の強さの順に並べると,チルゼパチド>セマグルチド>デュラグルチド=リラグルチド=経口セマグルチド>エキセナチドER>エキセナチドBID=リキシセナチドとなり,最も強い血糖降下作用を有するGLP-1受容体作動薬はチルゼパチドと考えられる。
3 臓器保護薬として
GLP-1受容体作動薬は血糖降下薬として開発されたが,アメリカ食品医薬品局(Food and Drug Administration:FDA)により心血管アウトカム試験(cardiovascular outcome trials:CVOT)の実施が要求された。CVOTの本来の目的は,新規血糖降下薬が既存の治療薬と比較して心血管イベントリスクを増やさないことを証明する非劣性試験である。したがって,その対象患者は心血管イベント発症の高リスク患者であり,試験の結果をエビデンスとして眼前の患者に適用する際には,個々の患者の持つ絶対リスク(absolute risk:AR)および治療必要数(number needed to treat:NNT)を常に考慮する必要がある。
チルゼパチドのCVOTであるSURPASS-CVOTは現在実施中であるが,これまでにリキシセナチドのELIXA(The Evaluation of Lixisenatide in Acute Coronary Syndrome)12),リラグルチドのLEADER(The Liraglutide Effect and Action in Diabetes:Evaluation of Cardiovascular Outcome Results)13),セマグルチドのSUSTAIN 614),エキセナチドERのEXSCEL(Exenatide Study of Cardiovascular Event Lowering)15),albiglutide(日本未発売)のHARMONY16),デュラグルチドのREWIND(Researching Cardiovascular Events With a Weekly Incretin in Diabetes)17),経口セマグルチドのPIONEER 618),efpeglenatide(日本未発売)のAMPLITUDE-O19)の結果が報告されている。
主要評価項目は,ELIXAのみが不安定狭心症による入院を加えた4-point MACE(major adverse cardiovascular events)であるが,それ以外の試験はすべて3-point MACEである(表3)。
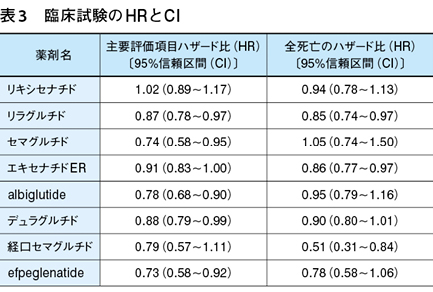

上記8試験のメタ解析20)では,MACEの発生は14%(HR:0.86,0.80〜0.93,P<0.0001),全死亡は12%(HR:0.88,0.82〜0.94,P=0.0001),心不全による入院は11%(HR:0.89, 0.82〜0.98,P=0.013),複合腎アウトカム(顕性アルブミン尿の発症,血清クレアチニンの倍加またはeGFRの40%以上低下,末期腎不全,腎関連死)は21%(HR:0.79,0.73〜0.87,P<0.0001)それぞれ減少した。
4 肥満症治療薬として
2022年に発表されたADA/EASDの高血糖管理アルゴリズム21)では,2型糖尿病治療において体重管理が血糖管理と同様に重要であることが強調された。血糖降下薬の中で体重減少作用が証明されているのはSGLT2(sodium glucose co-transporter 2)阻害薬とGLP-1受容体作動薬であるが,食欲抑制作用のあるGLP-1受容体作動薬は肥満症治療薬としての開発も進められてきた。前述した各薬剤の臨床開発プログラムにおいてもGLP-1受容体作動薬の体重減少作用は確認されている(表4)。
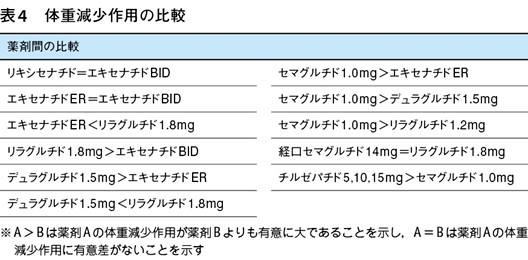
体重減少作用の強さの順に並べると,チルゼパチド>セマグルチド>リラグルチド=経口セマグルチド>デュラグルチド>エキセナチドER=エキセナチドBID=リキシセナチドとなり,ほぼ血糖降下作用とパラレルである。したがって,2型糖尿病患者において最も大きい体重減少作用を有するGLP-1受容体作動薬はチルゼパチドと考えられる。
2型糖尿病を合併しない患者の肥満症治療薬としての臨床開発プログラムは,リラグルチドのSCALE(Satiety and Clinical Adiposity - Liraglutide Evidence in Nondiabetic and Diabetic Individuals),セマグルチドのSTEP(Semaglutide Treatment Effect in People with Obesity),チルゼパチドのSU RMOUNT,そして経口セマグルチドのOASIS(Oral Semaglutide 50mg Taken Once Per Day in Adults with Overweight or Obesity)がある。肥満症治療薬としての用量設定はチルゼパチドを除いて血糖降下薬に比較して大量であり,リラグルチドは3.0mg,セマグルチドは2.4mg,経口セマグルチドは50mgに設定された。
結果を,プラセボに対する減量効果をパーセント(95%CI,P値)で示すと,リラグルチド3.0mg:−5.4%(−5.8~−5.0,P<0.001)22),セマグルチド2.4 mg:−12.4%(−13.4~−11.5,P<0.001)23),チルゼパチド:−17.8%(−19.3~−16.3,P<0.001)24),経口セマグルチド50mg:−12.7%(−14.2~−11.3,P<0.0001)25)である。各薬剤間での比較検討試験は報告されていないが,肥満症治療薬としてもチルゼパチドの体重減少作用が最大と思われる。
2023年7月時点で,セマグルチド2.4mg(ウゴービ®)が肥満症治療薬として製造承認されて薬価収載待ちの状況であるが,薬価収載されれば,マジンドール(サノレックス®)が1992年に販売開始されてから30年ぶりに,新しい肥満症治療薬が使用可能となる。
5 有害事象
インクレチン関連薬であるGLP-1受容体作動薬は,DPP-4阻害薬と同じく,急性膵炎や膵癌のリスク増大と関連する可能性が懸念されていた。しかし,前述した8つのランダム化比較試験のメタ解析の結果では,急性膵炎および膵癌のリスク増大とは関連しないことが報告されている。一方,2022年に報告された76試験のメタ解析26)では,GLP-1受容体作動薬の使用は胆囊・胆道疾患のリスク増大と関連しており(RR:1.37,95%CI:1.23〜1.52,以下同),特に胆石症(1.27,1.10〜1.47),胆囊炎(1.36,1.14〜1.62),および胆道疾患(1.55,1.08〜2.22)と関連していることが報告された。この関連は糖尿病の有無にかかわらず認められたが,投与量が多いほど,投与期間が長いほど,肥満症治療目的に使用された場合に,より大きいことが示された。
嘔気・嘔吐,下痢などの消化器症状は多くの患者でみられる。しかし,その程度には個人差が大きく,慎重な経過観察が必要である。低血糖のリスクは単独投与では低いと考えられるが,他の血糖降下薬,特にインスリンおよびSU薬と併用する場合には注意が必要である。また,GLP-1受容体作動薬の体重減少作用は利点である一方,特に高齢者では体重減少がフレイルにつながる可能性もあるため,慎重に患者を選択する必要があるだろう。
6 まとめ
GLP-1受容体作動薬は血糖降下作用,体重減少作用および臓器保護作用のエビデンスを有する薬剤であり,特に肥満を合併した2型糖尿病患者の治療には有用な薬剤である。経口血糖降下薬のみでは目標血糖値を達成できない場合に,インスリンの前にまず投与を試みてもよい血糖降下薬と位置づけられる。
また,肥満症治療薬としても期待されているが,あらかじめ肥満症治療の基本である食事療法・運動療法を行っても,十分な効果が得られない場合で,薬物治療の対象として適切と判断された患者のみに投与することが重要である。
最後になるがGLP-1受容体作動薬については,Medicine Matters® diabetesのサイト27)に情報が集約されているので,興味ある読者は参照されたい。
【文献】
1) Rosenstock J, et al:Diabetes Care. 2013;36(10): 2945-51.
2) Drucker DJ, et al:Lancet. 2008;372(9645):1240-50.
3) Buse JB, et al:Lancet. 2013;381(9861):117-24.
4) Buse JB, et al:Lancet. 2009;374(9683):39-47.
5) Wysham C, et al:Diabetes Care. 2014;37(8):2159-67.
6) Dungan KM, et al:Lancet. 2014;384(9951):1349-57.
7) Ahmann AJ, et al:Diabetes Care. 2018;41(2):258-66.
8) Pratley RE, et al:Lancet Diabetes Endocrinol. 2018; 6(4):275-86.
9) Capehorn MS, et al:Diabetes Metab. 2020;46(2): 100-9.
10) Pratley R, et al:Lancet. 2019;394(10192):39-50.
11) Frías JP, et al:N Engl J Med. 2021;385(6):503-15.
12) Pfeffer MA, et al:N Engl J Med. 2015;373(23): 2247-57.
13) Marso SP, et al:N Engl J Med. 2016;375(4):311-22.
14) Marso SP, et al:N Engl J Med. 2016;375(19):1834-44.
15) Holman RR, et al:N Engl J Med. 2017;377(13): 1228-39.
16) Hernandez AF, et al:Lancet. 2018;392(10157): 1519-29.
17) Gerstein HC, et al:Lancet. 2019;394(10193):121-30.
18) Husain M, et al:N Engl J Med. 2019;381(9):841-51.
19) Gerstein HC, et al:N Engl J Med. 2021;385(10): 896-907.
20) Sattar N, et al:Lancet Diabetes Endocrinol. 2021;9 (10):653-62.
21) Davies MJ, et al:Diabetes Care. 2022;45(11): 2753-86.
22) Pi-Sunyer X, et al:N Engl J Med. 2015;373(1):11-22.
23) Wilding JPH, et al:N Engl J Med. 2021;384(11): 989-1002.
24) Jastreboff AM, et al:N Engl J Med. 2022;387(3): 205-16.
25) Knop FK, et al:Lancet. 2023;402(10403):705-19.
26) He L, et al:JAMA Intern Med. 2022;182(5):513-9.
27) Medicine Matters® diabetes:GLP-1 receptor agonists.
https://diabetes.medicinematters.com/glp-1-receptor-agonists/18817774































